患者病史
患者,男,72岁,因“消瘦、乏力”就诊于当地医院,自述半年体重下降约10余斤,无发热,盗汗等症状。查体发现颈部、腋下及腹股沟可扪及多个肿大淋巴结,脾肋下可触及,肋下2cm。
辅助检查
外周血检测结果
当地:血常规示白细胞6.36*109/L,血红蛋白107g/L,血小板100*109/L,影像学提示多处浅表淋巴结、纵隔淋巴结、腹腔及腹膜后淋巴结肿大,脾大。病理:(左腋下淋巴结)淋巴组织反应性增生。
我院:免疫球蛋白定量:IgG 36g/L↑,IgM 4.28g/L↑,轻链K定量 3160mg/dl↑,轻链L定量 1200mg/dl↑,游离KAP轻链 87.7mg/L↑,游离LAM轻链 52.9mg/L↑,rFLC(κ-FLC:λFLC) 1.66↑。血β2微球蛋白 5.28mg/l↑。血免疫固定电泳:阴性(未见IgG、IgA、IgM、IgD、轻链κ、轻链λ单克隆成分)。
骨髓形态学检查:增生活跃,G=32%,E=19%,G/E=1.68:1。粒系减低,红、巨两系正常,淋巴细胞比例增高,可见不典型淋巴细胞,部分细胞胞质可见空泡、核仁。
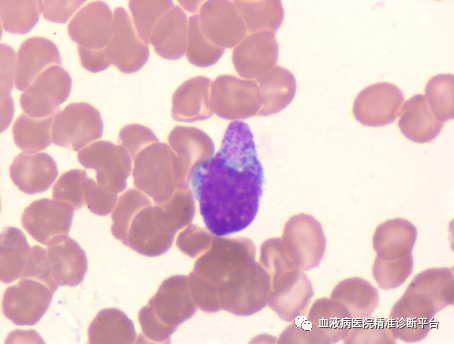
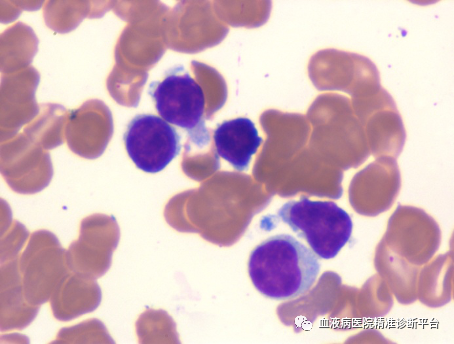
骨髓病理活检:HE及PAS染色示送检骨髓增生较活跃(60%-70%),异型淋巴细胞比例增高(约40%),散在或结节状分布,各阶段粒红系细胞散在分布,巨核细胞少见,可见含铁血黄素沉积。

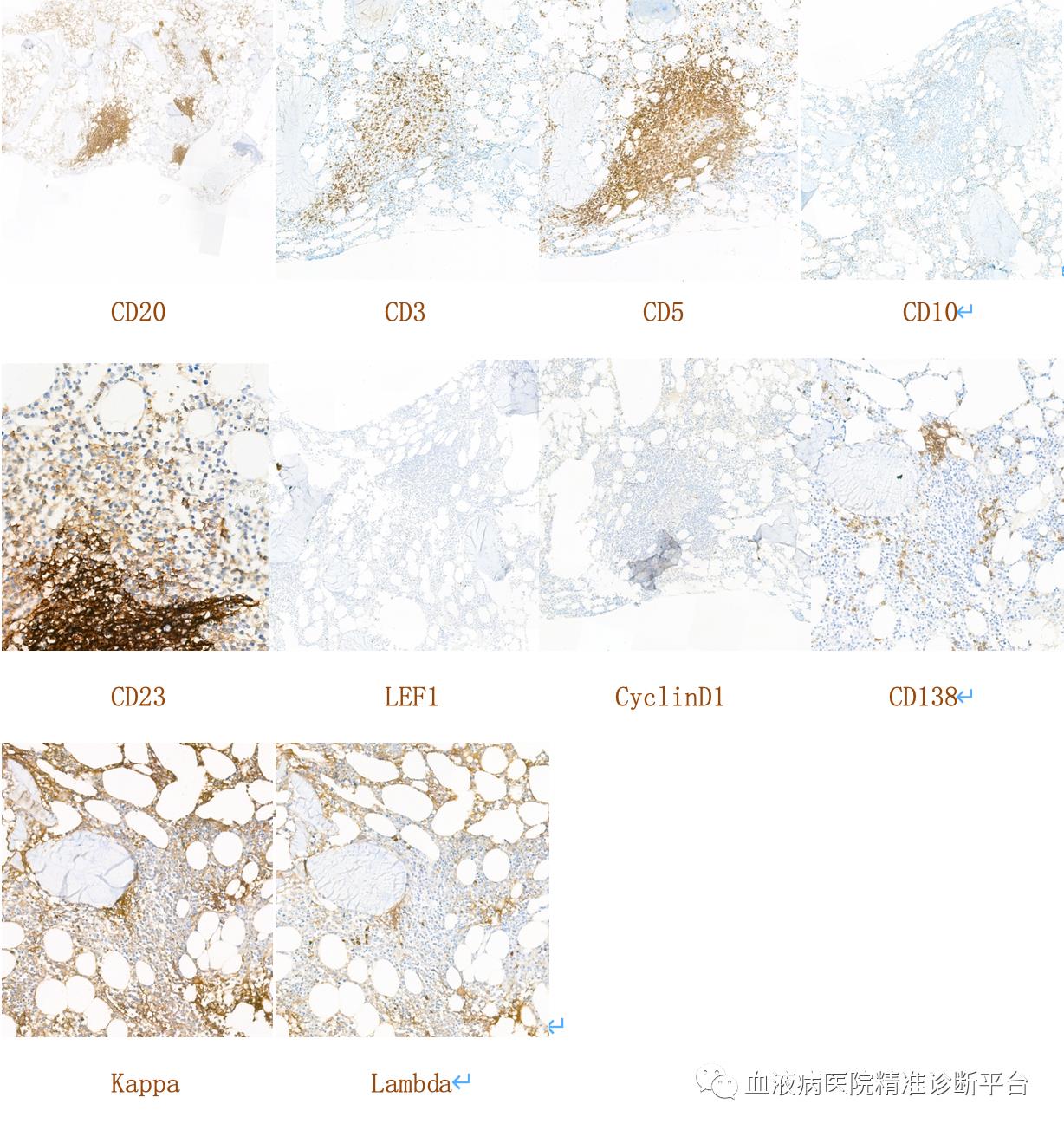
免疫组化:CD20+,PAX5+,CD3-,CD5+,CD10-,CD23部分弱+,CyclinD1-,CD138浆细胞+,Kappa浆细胞少数+,Lambda浆细胞个别+,LEF1-。
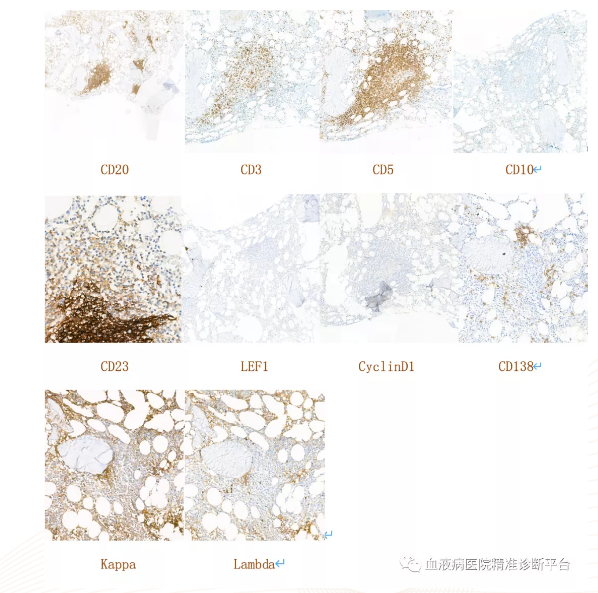
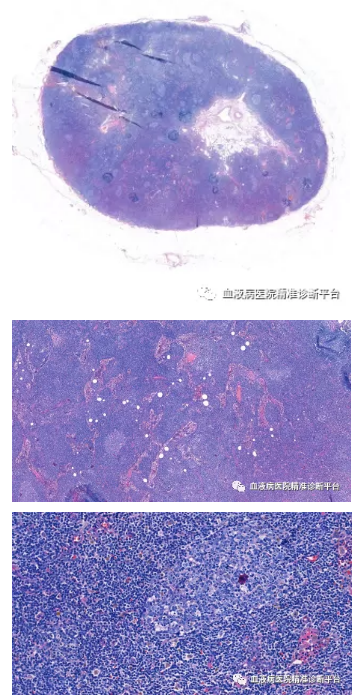
淋巴结切检:淋巴结结构紊乱,可见淋巴滤泡及淋巴窦,滤泡周围及滤泡间区异形小淋巴细胞增生,局部见较多浆细胞呈簇状分布,并见较多含铁血黄素沉积。
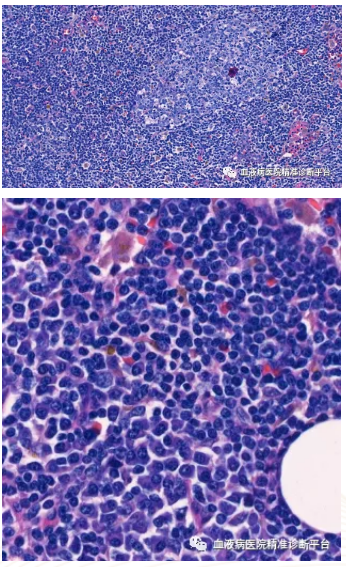
免疫组化:CD20+,PAX5+,BCL2+,CD5弱+,CD23部分弱+,CD21 FDC+,Ki67阳性率<10%,CD3-,CD10-,BCL6-,LEF1-,CD30-,CyclinD1-,CD138浆细胞+,Kappa浆细胞多量+,Lambda浆细胞少量+。
原位杂交EBER-。
流式细胞学
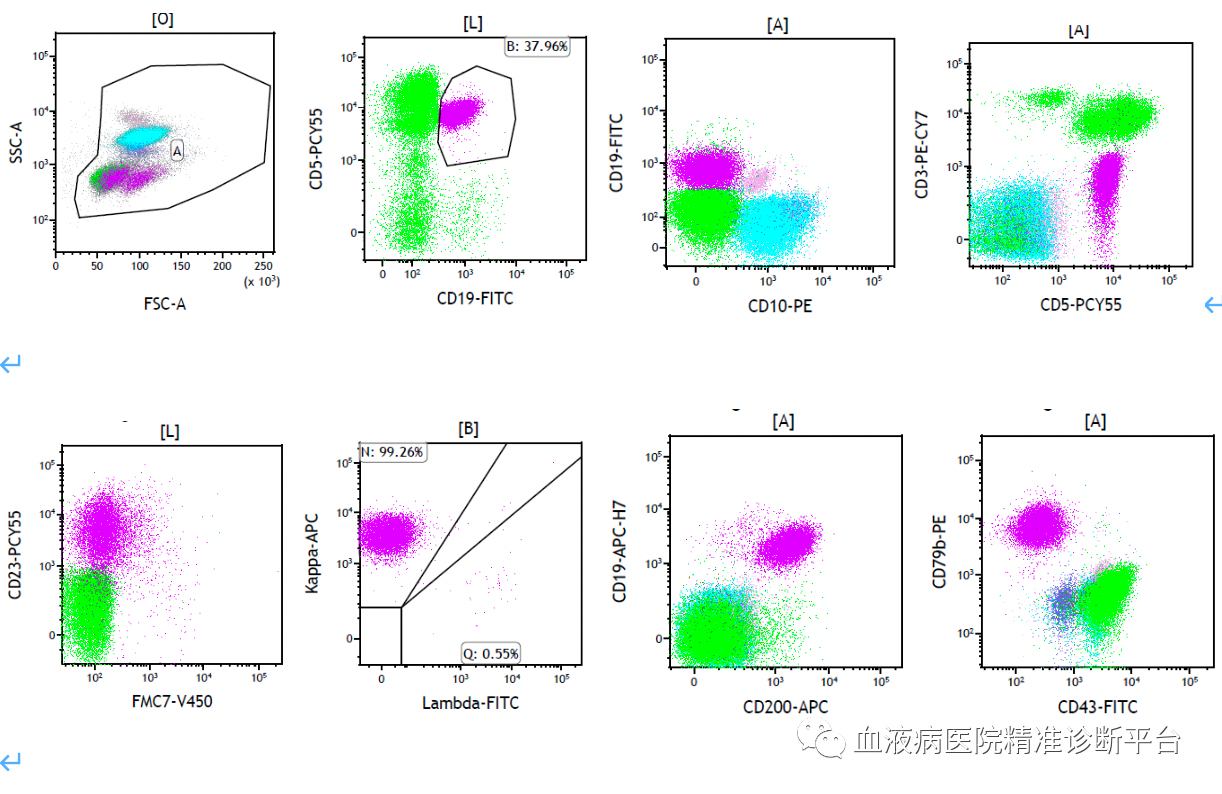
骨髓中异常细胞群约占有核细胞的14.18%,表达CD5,CD19,CD20,CD79b,CD25,CD23,CD200,CD22,CD81,sIgD,sIgM,Kappa,弱表达CD11c,不表达CD10,CD103,CD38,FMC7,Lambda,结论:为CD5+CD10-小B细胞淋巴瘤。
分子生物学检查
淋巴结:IGH+,TCRβ-,TCRγ-,IGK-。
病例分析
淋巴浆细胞淋巴瘤/华氏巨球蛋白血症(lymphoplasmacytic lymphoma/Waldenstrom's macroglobulinemia,LPL/WM)是一种较为罕见的惰性淋巴系统恶性肿瘤。在WHO分类中,将LPL定义为由小B淋巴细胞、浆细胞样淋巴细胞和浆细胞组成的肿瘤,通常累及骨髓、淋巴结和脾,亦可伴有其他结外器官受累,同时又不符合任何其他一种伴有浆细胞分化的小B淋巴细胞肿瘤的诊断标准。LPL侵犯骨髓同时伴有血清单克隆性IgM丙种球蛋白时诊断为WM。90% ~95%的LPL为WM,仅小部分LPL患者分泌单克隆性IgA、IgG成分或不分泌单抗隆性免疫球蛋白,少数患者既有IgM又有IgG或其他Ig类型。
LPL占非霍奇金淋巴瘤(NHL)的不到2%,男性稍多,中位发病年龄60-65岁,约20%伴有WM的患者有家族倾向。其临床表现主要是由淋巴浆细胞和血清IgM 两部分造成的。例如,淋巴浆细胞增殖/侵犯可以造成肝脾大、淋巴结肿大、全血细胞减少、以及中枢侵犯引起的Bing-Neel综合征。而高水平的血清单克隆IgM 会引起高粘滞反应,表现为头晕、黏膜出血和视物模糊等。另外,部分患者的血清单克隆IgM 还具有自身抗体效应,造成自身免疫现象,如免疫性溶血性贫血和血小板减少症、冷球蛋白血症、冷凝集素病和IgM 相关性周围神经病。最后,单克隆IgM 还会出现沉积效应,造成继发性轻链型淀粉样变或范可尼综合征等。
依据WHO分类定义,LPL细胞起源于生发中心后向浆细胞分化的阶段,此阶段发生了免疫球蛋白重链(IGH)基因可变区(V区)的高频突变,获得特异且高效的抗原结合性B细胞,从而促进抗体成熟,而未发生IG类别转化阶段,其理论依据即多数LPL患者IGHV基因发生突变,但同时绝大多数患者分泌单克隆性IgM抗体。但有文献报道部分LPL患者不分泌单克隆性IgM,却分泌单克隆性IgG或IgA,提示部分LPL患者细胞起源于IG发生类别转化之后。由于非WM型LPL所占比例低,相关研究较少,下面介绍WM相关标准,其诊断标准为
1.血清中检测到单克隆性的IgM(不论数量)。
2.骨髓中浆细胞样或浆细胞分化的小淋巴细胞呈小梁间隙侵犯(不论数量)。
3.免疫表型:CD19(+),CD20(+),sIgM(+),CD22(+),CD25(+),CD27(+),FMC7(+),CD5(+/-),CD10(-),CD23(-),CD103(-)。10%~20%的患者可部分表达CD5、CD10、或CD23,此时不能仅凭免疫表型排除WM。
4.除外其他已知类型的淋巴瘤。
5.有研究者报道MYD88 L265P突变在wM中的发生率高达90%以上 ,但其阳性检出率与检测方法和标本中肿瘤细胞的比例等有关,MYD88L265P突变也可见于其他小B细胞淋巴瘤、弥漫大B细胞淋巴瘤等。因此MYD88 L265P突变是WM诊断及鉴别诊断的重要标志,但非特异性诊断指标。
注:LPL/WM无特异的形态学、免疫表型及遗传学改变,故LPL/WM的诊断是一个排他性诊断,需要紧密结合临床表现及病理学等检查结果进行综合诊断。虽然通过骨髓检查可诊断LPL/WM,但如有淋巴结肿大仍建议尽可能获得淋巴结等其他
组织标本进行病理学检查,以除外其他类型淋巴瘤可能。
其中骨髓中的肿瘤细胞可呈间质性、结节状、小梁旁灶性及弥漫性分布,浆细胞和淋巴细胞内可见Dutcher小体,还可见肥大细胞增多,其可促进瘤细胞的增生,CD117免疫组化染色可以帮助识别,也可伴随含铁血黄素沉积。LPL/WM侵犯淋巴结,常累及淋巴结副皮质区和边缘窦,簇状或小灶性分布,常有少量淋巴窦和淋巴滤泡存在,也可完全破坏;瘤细胞由小淋巴细胞、浆细胞样淋巴细胞和浆细胞组成,伴有少数转化的细胞。Dutcher小体、肥大细胞和含铁血黄素增加也是其特征。不见CLL/ SLL中可见的增殖中心,可见淀粉样物质、其他免疫球蛋白沉积或储存结晶的组织细胞。当出现大量大淋巴细胞时,应注意是否有大B细胞淋巴瘤转化的可能。
本例患者以消瘦、淋巴结肿大入院,取左腋窝淋巴结当地病理诊断淋巴组织反应性增生。我们观察淋巴结结构紊乱,可见淋巴滤泡及淋巴窦,可见窦扩张,滤泡周围及滤泡间区异形小淋巴细胞增生,局部见较多浆细胞呈簇状分布,并见较多含铁血黄素沉积。免疫组化显示异常小淋巴细胞表达B细胞抗原(CD20、PAX5),弱表达CD5和CD23,不表达CD10和CyclinD1,基因重排显示IgH阳性,可以诊断为CD5+CD10-小B细胞淋巴瘤。骨髓中也可见到异形小淋巴细胞增多伴少量浆细胞,该类淋巴细胞同样表达B细胞抗原,表达CD5,CD23,不表达CD10,流式细胞学检测也证实了该类表型,骨髓也诊断为CD5+CD10-小B细胞淋巴瘤。
本例有免疫球蛋白IgM、IgG升高,存在B淋巴细胞和浆细胞的细胞成分,诊断应考虑到LPL,LPL/WM需要鉴别诊断包括IgM型意义未明的单克隆免疫球蛋白血症(MGUS), IgM型多发性骨髓瘤(MM),伴有血清单克隆性IgM成分的多种B—CLPD(如慢性淋巴细胞白血病/小淋巴细胞淋巴瘤、套细胞淋巴瘤、滤泡性淋巴瘤、边缘区淋巴瘤),其中与边缘区伴有浆细胞分化时尤其难以鉴别。
本例患者虽有免疫球蛋白升高,但未检测到单克隆免疫球蛋白,淋巴结中不表达CD10、CyclinD1,形态学未见“单核样”或边缘区细胞学特征,需要鉴别的疾病主要为慢性淋巴细胞白血病/小淋巴细胞淋巴瘤与淋巴浆细胞淋巴瘤。虽然可见浆细胞的增多,但不能鉴别二者,组织结构上可见淋巴滤泡的残留和窦的存在,未见增殖中心的形成,并可见较多含铁血黄素沉积,免疫组化显示浆细胞Kappa/Lambda比值明显增高,提示浆细胞为克隆性改变,同时B淋巴细胞LEF1为阴性,骨髓和淋巴结的MYD88 L265P突变均为阳性,故最终诊断为LPL。
本例病例提示我们,LPL大部分是一种排除性诊断,鉴别诊断主要包括IgM增高的浆细胞及B细胞肿瘤,尤其在以淋巴结肿大就诊的患者中,常常误诊为其他小B细胞淋巴瘤。
虽然本病例主要需与CLL/SLL相鉴别,但大多数情况下更为困难的是MZL和LPL的鉴别,WHO强调单核样B细胞支持MZL的诊断,但在部分LPL/WM中也能见到单核样B细胞,甚至其他类型的淋巴瘤也会有单核样B细胞分化。此外,LPL/WM病变中常出现Dutcher小体,也不是LPL/WM 独有的特征。临床上,虽然大多数MZL患者表现为无症状的淋巴结肿大,但少数也会累及骨髓和外周血,偶尔也存在血清IgM蛋白升高,这就给诊断和鉴别诊断带来了极大挑战。MYD88 L265P突变出现在绝大部分的LPL中,但其他B细胞淋巴瘤,如DLBCL、CLL和MZL中也可见到。但如病变累及淋巴结的同时伴有骨髓受累和血清IgM蛋白增高、贫血等一系列临床表现,并且分子遗传学显示MYD88 L265P突变则高度支持LPL/WM的诊断。
参考文献
1、Swerdlow SH.Campo E, Harris NL, et al. WHO Classfication of Tumors of Haematopoietie and Lymphoid Tissues[M]. Revised 4th ed. Lyon, France:IARC Press,2017.
2、中国抗癌协会血液肿瘤专业委员会,中华医学会血液学分会白血病淋巴瘤学组,中国抗淋巴瘤联盟.淋巴浆细胞淋巴瘤/华氏巨球蛋白血症诊断与治疗中国专家共识(2016年版).中华血液学杂志,2016,37(9):729-734.
3、GARCIA-SANZ R,JIMENEZ C,PUIG N,et al.Origin of Waldensrom’s macroglobulinaemia.Best Pract Res Clin Haematol,2016,29(2):136-147.
4、De Sanjose S,Benavente Y,Vajdic C M,et al.Hepatitis C and non-Hodgkin lymphoma among 4784 cases and 6269 controls from the International lymphoma Epidemiology Consortium[J].Clin Gastroenterol Hepatol,2008,6(4):451-458.
5、Elaine S.Jaffe,Daniel A.Arber,Elias Campo,et al.Hematopathology 2nd Edition.Elsevier,Inc,2017.
6、Cao XX,Meng Q,Mao YY,et a1.The clinical spectrum of IgM monoclonal gammopathy:A single center retrospective study of 377 patients[J].Leuk Res,2016,46:85— 88.
7、中华医学会血液学会、中国抗癌协会血液肿瘤专业委员会.中国B细胞慢性淋巴增殖性疾病诊断专家共识(2014年版)[J]中华血液学杂志,2014,35(4):367-370.doi:10.3760/cma.j.issn.0253-2727.2014.04.028.
8、CAO X,MEDEIROS L J,XIA Y,et al.Clinicopathologic features and outcomes of lymphoplasmacytic lymphoma patients with monoclonal IgG or IgA paraprotein expression[J].Leuk Lymphoma,2016,57(5):1104-1113.
撰稿:李占琦
编辑:曲晓宁
审核:孙琦
骨髓、淋巴结:脱氧核糖核酸测序-MYD88(L265P):阳性。







 津公网安备12010102000385号
津公网安备12010102000385号