近年来,基因治疗、免疫治疗和再生医学等领域不断取得重大突破。经CRISPR技术进行基因编辑后的人多潜能干细胞iPSC,经过基因修饰、可靶向识别肿瘤的CAR-T细胞等具有重要临床应用价值,但由于这些细胞基因编辑效率(特别是HDR或精准基因插入效率)有限,阻碍其在临床上的广泛使用[1,2]。因此,探究细胞基因编辑后动力学修复机制,并有效提高HDR效率,是细胞治疗应用于临床需要解决的一个瓶颈问题。

2021年1月25日,中国医学科学院血液病医院(中国医学科学院血液学研究所)实验血液学国家重点实验室张孝兵/程涛/张磊团队在《核酸研究》杂志发表题为“Dynamics and competition of CRISPR–Cas9 ribonucleoproteins and AAV donor-mediated NHEJ, MMEJ and HDR editing”的研究论文,首次揭示了CRISPR-Cas9核糖核蛋白联合AAV供体进行基因编辑后NHEJ、MMEJ及HDR各编辑结果间动力学竞争关系。
当DNA双螺旋结构断裂后,细胞会立即启动DNA损伤修复机制,主要包括经典的非同源末端连接(c-NHEJ/NHEJ)、非传统的末端连接或微同源介导的末端连接(alt-EJ/MMEJ)和同源模板指导的精确修复(HDR)等[3]。DNA断裂修复过程可能会破坏基因的开放阅读框,造成等位基因敲除。在提供HDR模版的情况下,可实现基因的精确敲入。目前,HDR供体主要包括质粒、单链寡脱氧核糖核苷酸(ssODN)和AAV等。
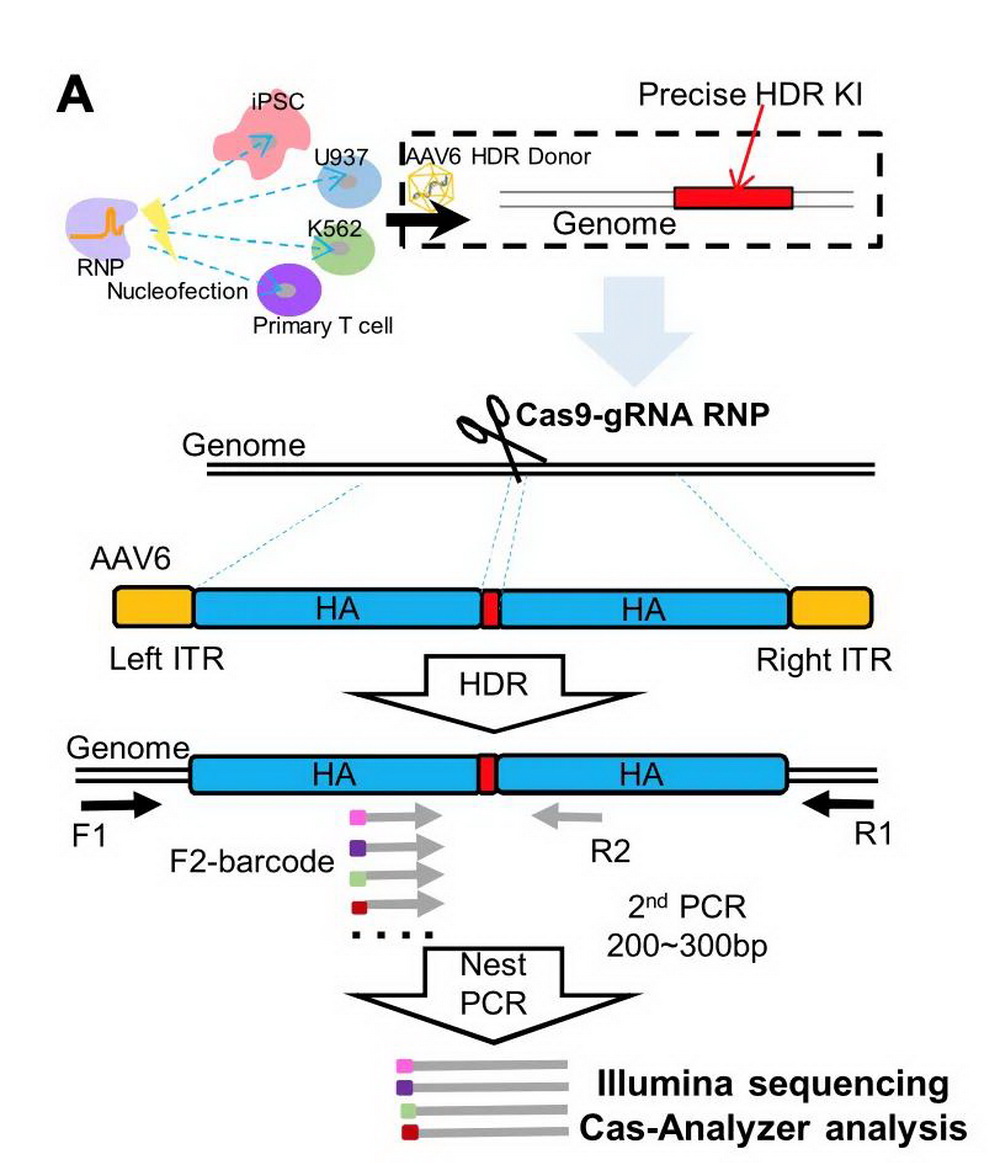
使用RNP和AAV6 HDR供体模板进行精确HDR编辑的示意
作者在成人外周血重编程来源的iPS细胞、原代T细胞、人慢性髓性白血病细胞株K562细胞和单核白血病细胞株U937等四种细胞类型中,对超过80个位点进行基因编辑,然后在不同的时间点收集细胞,PCR扩增编辑位点临近序列,进行高通量测序分析,获得编辑模式的详细图谱(上图)。结果表明,不同导向RNA(gRNA)、不同细胞类型间基因编辑效率和模式存在明显差异。将RNP电转后5个连续时间点的各个代表性DNA修复情况的频率绘制成图,取效率达到最大值的一半(50%)时的时间数值作为该编辑情况的T50,统计分析得出在四种细胞中各个代表性修复途径的发生速度。作者发现CRISPR-Cas9基因编辑后,NHEJ的发生速度最快,接下来是HDR,而MMEJ修复最慢,这就解释了基因编辑后经常发生高比例A/T(腺苷酸或胸腺嘧啶)插入的原因。当提供AAV6 HDR供体模版时,MMEJ介导的长片段缺失显著减少,但NHEJ介导的插入缺失不受影响。
由于NHEJ是修复DNA断裂损伤最主要且快速的修复途径,一定程度上阻碍了HDR的发生,作者期望寻找有效的NHEJ抑制剂提高HDR的效率。经过对14种小分子药物及其不同组合的测试,首次报道两种小分子M3814(NHEJ抑制剂)和Trichostatin A(TSA,HDAC抑制剂)的组合能够有效抑制NHEJ,提高了期望的HDR编辑结果。M3814+TSA这种小分子化合物组合适用于多种细胞(在人iPSC和T细胞中提高HDR效率2~4倍)以及多种模板载体(质粒载体及AAV载体)。
总之,该研究首次揭示了CRISPR RNP-AAV系统基因编辑后NHEJ、MMEJ及HDR各编辑结果间动力学竞争关系,利用M3814+TSA小分子组合抑制NHEJ+A/T将成为多种细胞类型中提高HDR效率的通用策略,从而实现CRISPR基因编辑技术的普遍应用。
中国医学科学院血液病医院(中国医学科学院血液学研究所)实验血液学国家重点实验室张孝兵教授、程涛教授和血栓止血诊疗中心张磊教授是本文的共同通讯作者。中国医学科学院血液病医院(中国医学科学院血液学研究所)博士生傅雅文、代新岳和助理研究员王文天为本文的共同第一作者。
[1] Kim, M.Y., Yu, K.-R., Kenderian, S.S., Ruella, M., Chen, S., Shin, T.-H., Aljanahi, A.A., Schreeder, D., Klichinsky, M. and Shestova, O. (2018) Genetic inactivation of CD33 in hematopoietic stem cells to enable CAR T cell immunotherapy for acute myeloid leukemia. Cell, 173, 1439-1453. e1419.
[2] Lu, Y., Xue, J., Deng, T., Zhou, X., Yu, K., Deng, L., Huang, M., Yi, X., Liang, M., Wang, Y. et al. (2020) Safety and feasibility of CRISPR-edited T cells in patients with refractory non-small-cell lung cancer. Nat Med, 26, 732-740.
[3] Chapman, J.R., Taylor, M.R. and Boulton, S.J. (2012) Playing the end game: DNA double-strand break repair pathway choice. Mol Cell, 47, 497-510.
撰稿:代新岳
编辑:柴子越
校对:徐龙彪
审核:祁健伟 周家喜

