骨髓造血微环境由骨髓中邻近造血干/祖细胞(hematopoietic stem/progenitor cells, HSPCs)的支持细胞构成,包括间充质基质细胞(mesenchymal stromal cells, MSCs)、交感神经细胞和免疫细胞等。微环境各组分以及造血干/祖细胞之间形成复杂的信号网络,精密调控血细胞的起源、增殖、分化和发育成熟过程。
原发性血小板增多症(essential thrombocythemia, ET)是一组发生在造血干/祖细胞水平的以成熟血细胞的过度增殖为主要特点的克隆性疾病,在WHO分类中属于经典的Ph染色体阴性的骨髓增殖性肿瘤(myeloproliterative neoplasms, MPN)的一种,JAK2V617F是其最常见的突变类型。已有研究报道JAK2突变的MPN小鼠的骨髓微环境存在明显异常(图1),但是鉴于物种之间结构,功能和免疫表型等的差异,小鼠模型可能无法完全反映人体的情况。
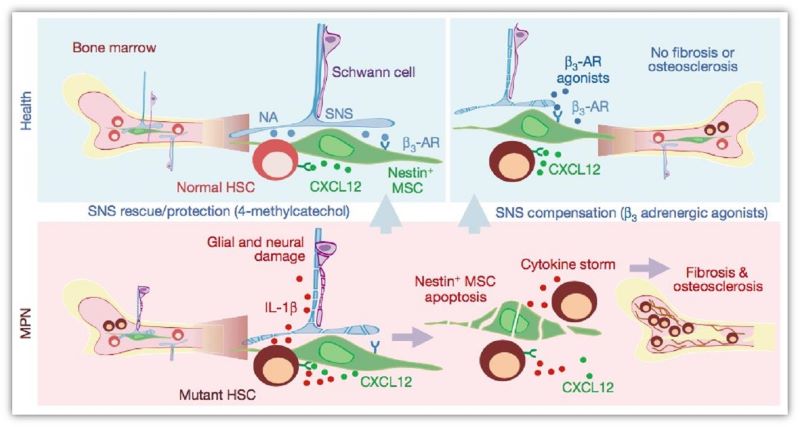
图1. MPN小鼠骨髓微环境存在明显异常【1】
2019年7月9日,来自中国医学科学院血液病医院(血液学研究所)的张磊和杨仁池课题组在Haematologica杂志在线发表题为Multilevel Defects In The Hematopoietic Niche In Essential Thrombocythemia的研究论文,该研究系统地揭示了JAK2V617F阳性ET患者骨髓造血微环境中多层次、多系统的缺陷,包括MSCs转录组异常以及MSCs、交感神经系统和免疫系统的功能异常,并提出差异表达分子WDR4可能是患者MSCs出现大多数功能异常的分子基础。

研究人员首先通过转录组学分析,发现ET患者来源的MSCs表现出与细胞增殖、分化、衰老以及炎症和造血支持异常相关的显著富集的基因特征,并通过功能实验进一步验证了转录分析的结果,证实患者来源的MSCs确实存在增殖增强、凋亡、衰老和分化减弱,以及正常造血支持能力受损和免疫调节功能异常等缺陷。
在明确了ET患者MSCs的功能异常后,研究人员通过基因干预策略和多种特异性抑制剂发现WD重复蛋白家族成员WDR4在患者MSCs中的低表达导致其增殖增强,衰老和分化减弱,并且证实WDR4-ERK-GSK3β-CREB-IL-6轴作用减弱是患者MSCs正常造血支持能力受损的分子机制之一。
此外,研究人员在ET患者的骨髓病理活检组织中检测到明显的交感神经损伤,并提出骨髓中异常增多的IL-1β可能是患者交感神经病变的原因之一。
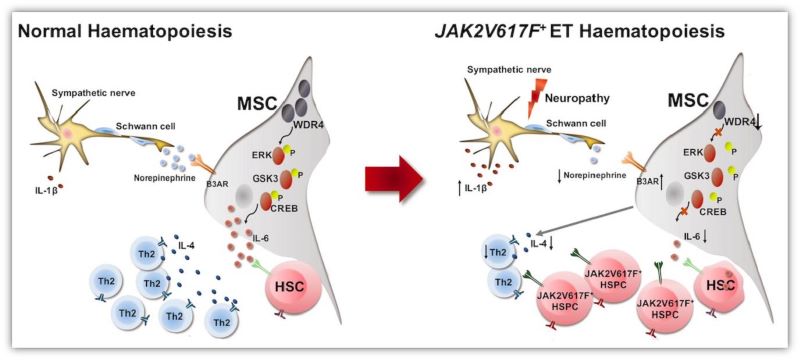
ET患者骨髓微环境异常改变模式图
总之,该研究系统地比较了正常供者和JAK2V617F阳性的ET患者的骨髓微环境,全面揭示了患者骨髓微环境的变化,并深入挖掘了与患者骨髓微环境改变密切相关的潜在分子机制,为JAK2V617F阳性ET的发病机制研究以及靶向微环境的治疗提供了理论依据。
原文链接:lhttp://www.haematologica.org/content/early/2019/07/08/haematol.2018.213686.full.pdf+htm