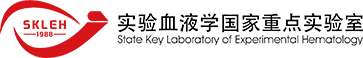重编程技术的发展为再生医学的研究提供了无限可能。然而,重编程过程的发生不但依赖于有致癌性的重编程因子(Oct4, Sox2, Klf4, c-Myc,以下简写为OSKM),而且重编程过程的发生与肿瘤的发展过程比较类似。不论是正常细胞被诱导变为诱导性多能干细胞,即iPSCs(induced pluripotent cells),还是经过肿瘤形成变成肿瘤细胞,都是一个逆分化的过程,需要克服一系列的表观遗传学障碍(epigenetic barriers)才能获得新的细胞特性(干性或恶性)。那么,如果在已经癌化的肿瘤细胞中过表达具有致癌性的重编程因子,肿瘤细胞又会发生怎样的变化呢?程涛课题组前期研究证明了原代急性髓系白血病细胞(Liu Y, et al. Leukemia 2014)和急性淋巴白血病细胞(Zhang H, et al. Blood Cancer Journal 2016)可以被重编程为iPS细胞,但效率极低。那么绝大部分白血病细胞到底发生了什么变化?
2019年12月6日,中国医学科学院血液病医院(中国医学科学院血液学研究所,以下简称血研所)的程涛/程辉课题组与南方医科大学颜光玗课题组联合在Nature Communications上发表了名为《Targeting of apoptosis gene loci by reprogramming factors leads to selective eradication of leukemia cells》的文章。该文章的第一作者分别为血研所博士毕业生(现云南省第一人民医院助理研究员)王娅婕,南方医科大学博士研究生卢婷,血研所博士研究生孙国欢以及血研所移植科助理研究员郑亚伟。该研究还得到了同济大学高绍荣教授的协助。他们发现,在白血病小鼠中过表达重编程因子后,重编程因子会通过打开白血病细胞中凋亡基因所在的染色质,使白血病细胞中与细胞凋亡相关的基因表达,并造成白血病细胞进行凋亡而被选择性清除,而短时间地启动重编因子对正常造血干/祖细胞的影响较小。并且这一针对白血病细胞的选择性清除现象在人源细胞中同样适用。
在文章中,作者首先构建了Doxycycline(Dox)可诱导OSKM高表达的急性髓系白血病(MLL-AF9 AML)模型。随后,在实验组内,作者针对不同发病情况的白血病小鼠(以白血病细胞在小鼠骨髓内的浸润度为分类)连续7天喂食含Dox的水,而对照组则喂食不含Dox的水,随后对实验组与对照组小鼠一年内的生存率进行统计。统计发现对照组的小鼠在一个月内全部死亡,而实验组的小鼠的一年生存率则都有不同程度的提高,其中最开始白血病细胞骨髓浸润度在10~20%的所有小鼠生存时间均超过一年(如下左图所示)。作者通过流式分析与共聚焦显微镜的镜下观察,发现实验组小鼠不论是骨髓还是脾脏中,白血病细胞的比例逐渐下降并最终消失(如下右图所示)。为了探究该现象的普遍性,作者同样在另一种AML小鼠模型(MLL-NRIP3)和急性T淋巴细胞白血病模型(Notch1)中进行了类似的实验,结果同样发现小鼠的生存率都有了显著提高。该结论初步表明在白血病细胞中过表达OSKM可以显著提高白血病小鼠的生存率,且该结果具有一定的普遍性。
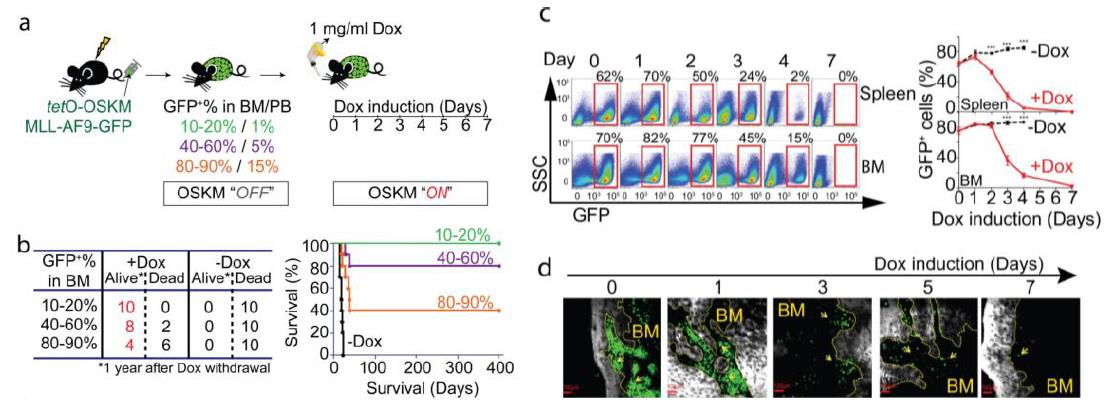
那么过表达OSKM后白血病细胞下降以至完全消失这一现象是否具有特异性呢?如果白血病细胞与正常的造血细胞同时过表达OSKM又会发生什么?小鼠的生存率是否依然会提升?白血病细胞是否会继续消失?正常造血细胞又会经历怎样的命运呢?为了解决以上问题,作者在MLL-AF9小鼠中进行了进一步的研究。作者利用共移植的方式将AML细胞与正常且同样可被Dox诱导OSKM过表达的正常骨髓细胞(来自CD45.2小鼠)移植进了致死剂量照射的小鼠,并对共移植后的小鼠进行了同样设计的实验(如下图a所示)。结果发现对照组小鼠在40天内全部死亡,而实验组的小鼠的生存率则有了显著的提升。类似的,我们发现不论是在小鼠的脾脏或骨髓中,白血病细胞都逐渐减少至消失,而正常造血细胞的数量则逐渐增加(如下图b所示)。以上结果表明在在小鼠中如果白血病细胞与正常造血细胞同时过表达OSKM,小鼠的生存率依然有着显著的提升,白血病细胞继续消失,而正常的造血细胞则几乎不受影响。
值得注意的是,为了进一步探索该现象在未来的临床治疗中是否有着启示意义,作者在人脐带血的CD34+细胞与THP-1白血病细胞中利用慢病毒进行OSKM的转染,结果发现CD34+细胞几乎不受影响,而白血病细胞的数量却急剧下降,且白血病细胞的成克隆能力也受到了明显的影响。该结果表明OSKM对白血病细胞的选择性清除不止局限于小鼠模型,在人源细胞中也同样适用。
为了进一步探索造成白血病细胞选择性清除的原因,作者利用转录组数据与染色质开放性区域的数据对可能的原因做了初步探索,并猜想免疫反应以及细胞凋亡可能是造成白血病细胞被选择性清除的原因。随后作者通过功能实验证明了T细胞、B细胞、NK细胞以及巨噬细胞不是造成白血病细胞被选择性清除的原因,并提出了是由于OSKM打开了白血病细胞中凋亡相关基因的染色质,从而使白血病细胞中与细胞凋亡相关的基因表达,并造成白血病细胞进行凋亡这一可能机制。
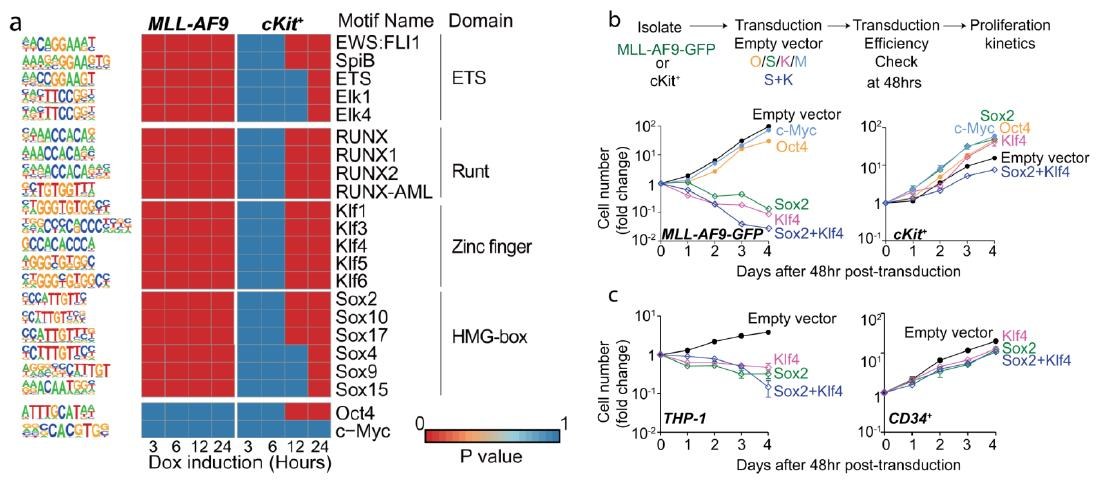
那么,在白血病细胞的选择性清除中,OSKM中哪个或者哪几个因子起到了更为重要的作用呢?OSKM是否都是这一现象所必不可少的因子?为了回答这个问题,由于转录因子主要集中结合在增强子区与启动子区,故而作者在差异的染色质开放区域内进行了转录因子的motif富集分析,并选出了排名前20的转录因子。结果发现在排名前20的转录因子内,OSKM中Sox与Klf家族的motif有着明显的改变,而c-Myc的motif并未出现明显变化,Oct4的motif也只在cKit+细胞中12小时后出现变化(如下左图所示),由此推测是否只有Klf4与Sox2参与了白血病细胞的选择性清除这一过程呢?为了验证以上猜想,作者在小鼠细胞与人源细胞中分别进行了功能验证,并证明了是Klf4与Sox2,而非Oct4与c-Myc在白血病细胞被选择性清除的过程中起到了主要作用(如下右图所示)。
染色质状态的改变通常也伴随着组蛋白修饰的变化,为此,作者检测了该过程中组蛋白修饰的变化,最终发现不论是过表达OSKM四因子还是过表达Klf4与Sox2双因子,H3K9me3均在该过程中逐渐下降,那么H3K9me3的下降是否与白血病细胞的选择性清除作用相关呢?为了回答这个问题,作者在小鼠白血病细胞、骨髓细胞、人正常CD34+细胞以及白血病CD34+中加入了H3K9me3的抑制剂chaetocin,结果发现不论是小鼠白血病细胞还是人白血病细胞,白血病细胞的数量均下降,且白血病细胞凋亡升高(如下图所示),同时小鼠白血病细胞的克隆形成能力也明显降低。值得注意的是,chaetocin对正常细胞影响有限。为了对H3K9me3是否参与该现象进行更进一步的探究,作者还在小鼠细胞内针对H3K9me3的去甲基转移酶Kdm3a进行了敲降和过表达实验,结果证实了H3K9me3确实参与了白血病细胞的选择性清除用,并提示了该现象临床转化前景。
该文章的研究除了对于白血病治疗提供了新的可能外,更重要的是开拓了目前对于重编程因子的研究与应用范围,即重编程因子除了可以使已分化的细胞重新获得干性变成iPS细胞,还可以促使癌细胞死亡。为此,作者认为重编程因子选择性清除白血病细胞这一现象正体现了我国哲学上--物极必反这一概念,即对于已经拥有干性以及无限增殖与分化潜能的白血病干细胞而言,诱导其继续获得无限增殖的潜能时(即诱导其成为iPSCs时),细胞会从一个无限增殖的状态走向另一个极端—死亡。据悉该研究已获得国际PCT优先权和中国专利的授权。