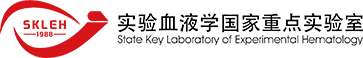近年来,CD19嵌合抗原受体T细胞(CAR-T)疗法成为突破性进展,使很多难治复发急性B淋巴细胞白血病(B-ALL)患者获得完全缓解[1,2]。然而,仍有30%-50%的患者在治疗缓解后复发。高复发率的原因主要是肿瘤细胞靶抗原丢失/下调或CAR-T细胞持续时间较短[3]。北京高博博仁医院和中国医学科学院血液病医院(中国医学科学院血液学研究所)等合作,建立了CD19和CD22 CAR-T序贯输注治疗儿童B-ALL的方法。该疗法主要特点是在CD19 CAR-T输注一个月获得完全缓解后,再用CD22 CAR-T进行巩固治疗。这种设计首先是使两次输注之间有一定间隔,从而避免同时使用不同CAR-T细胞可能增加的毒性。另外一方面,由于单靶点CAR-T细胞疗法的早期复发率较高,如果回输间隔时间过长,也可能导致CD22 CAR-T治疗前疾病就已复发,从而无法实现提高长期无病生存的目标。该研究旨在探索CD22 CAR-T细胞在CD19 CAR-T细胞回输后维持疾病长期缓解的潜力。CD19 CAR-T和CD22 CAR-T细胞序贯疗法的I期临床试验结果已于2020年发表在《Blood》期刊上[4]。美国国家癌症研究所(NCI)的Nirali N. Shah博士在《Blood》同期撰文评述,关注了这种方法,并将其比喻为连击两拳(one-two punch),但也提出相关结果需要将来在更大规模样本中进一步验证。
2023年10月17日,潘静/冯晓明合作团队在《The Lancet Oncology》(IF=51.1)在线发布了题为“Sequential CD19 and CD22 chimeric antigen receptor T-cell therapy for childhood refractory or relapsed B-cell acute lymphocytic leukaemia: a single-arm, phase 2 study”的研究论文。此研究发现序贯CD19和CD22 CAR-T疗法能有效降低儿童急性B淋巴细胞白血病复发率,揭示了序贯疗法在提高白血病CAR-T治疗长期疗效的重要价值。

II期临床试验采用了与I期临床试验相同的慢病毒载体、肿瘤细胞抗原表达率标准和淋巴细胞清除预处理方案,研究目标为在更大的人群样本中,验证序贯疗法的长期疗效和安全性。该疗法使用的CD19 CAR和CD22 CAR慢病毒载体及相应检测引物等由上海雅科生物技术有限公司张鸿声提供。
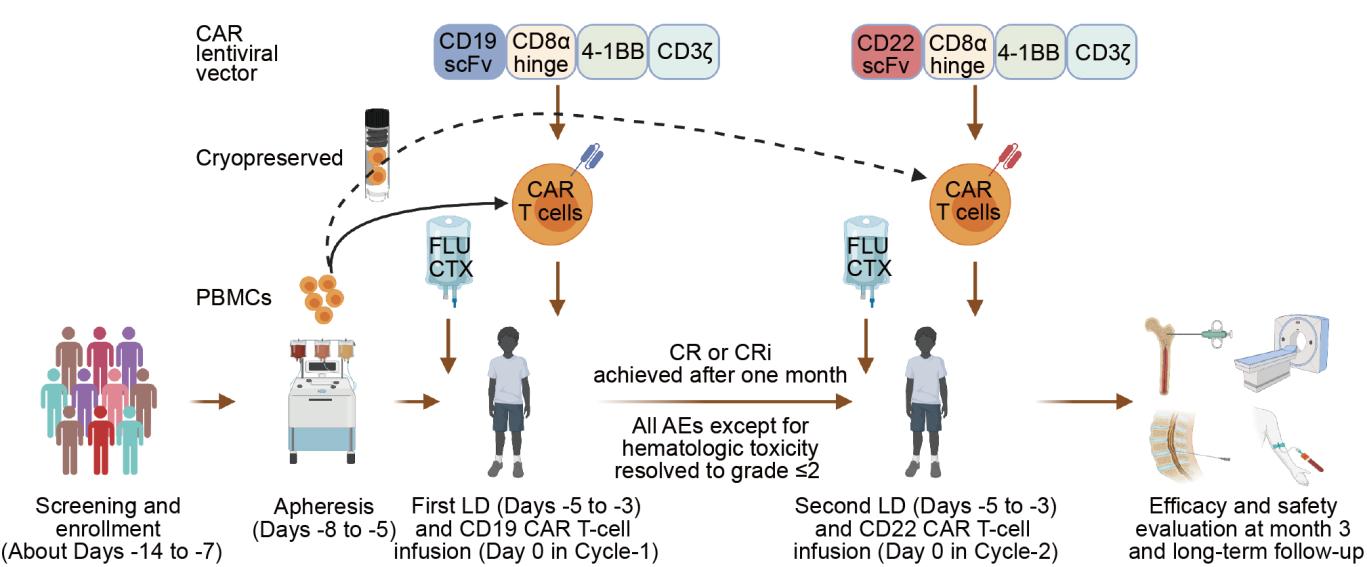
在2020年5月28日至2022年8月16日期间,该II期临床试验共筛选了102名患者。81名患者最终入组并回输CD19 CAR-T细胞,其中79名患者继续回输CD22 CAR-T细胞。两次输注CAR-T细胞的中位间隔时间为39天,中位随访时间为17.7个月。CD19 CAR-T细胞回输后第3个月时,接受靶剂量的62名患者中97%的患者达到完全缓解,10%的患者接受了移植巩固治疗,18个月的无事件生存率和总体生存率分别为79%和96%。截止2022年12月20日,共有19%的患者复发,其中20%为CD19−CD22-/+复发,低于既往的单靶点CD19或CD22 CAR-T疗法的总复发率和抗原阴性复发率[1,5]。在最后一次随访中,45%的患者外周血中可检测到CAR载体转基因,77%的患者保持B细胞耗竭状态。
该II期临床试验还进一步探索了序贯疗法的安全性。CD19或CD22 CAR-T细胞输注后30天内,≥3级的细胞因子释放综合征、神经毒性及感染的发生率分别为19%,5%及6%。未发生治疗相关的死亡,严重的长期副反应很少。
但该II期临床试验尚存在一些局限性,从整体来说,病人的基线情况较好,这可能也和较好的预后相关。部分患者接受了移植和/或地西他滨的巩固治疗,部分患者的随访时间少于一年,这些可能会影响临床试验结果的解读,但会被考虑进今后的临床研究中。
综上所述,该研究是评估了CD19、CD22 CAR-T细胞序贯策略作为难治复发急性B淋巴细胞白血病患儿治疗方案的前瞻性II期临床试验。初步结果显示,该方案相对于单药的CD19 CAR-T或CD22 CAR-T疗法,能降低早期复发率,使急性B淋巴细胞白血病患儿获得长期的疾病缓解和生存,且副反应总体可控,为后续研究(如随机对照试验)带来重要启示。
高博医学(血液病)北京研究中心北京高博博仁医院潘静主任医师为通讯作者。高博医学(血液病)北京研究中心北京高博博仁医院潘静主任医师、中国医学科学院血液病医院(中国医学科学院血液血液学研究所)博士生唐凯婷、罗悦晨副研究员、冯晓明研究员为同等贡献作者。潘静主任医师和冯晓明研究员共同指导了本项研究。该项目受国家重点研发计划、中国医学科学院医学与健康科技创新工程以及中国医学科学院中央级公益性科研院所基本科研业务费等基金支持。
该研究也获得美国宾西法尼亚大学儿童医院Regina M Myers和Stephan A Grupp教授在同期《The Lancet Oncology》以“Driving two chimeric antigen receptors (CARs) in a row to reduce antigen escape in B-cell acute lymphocytic leukaemia”为题进行了专文评述。
参考文献:
1. Shah NN, Lee DW, Yates B, et al. Long-term follow-up of CD19-CAR T-cell therapy in children and young adults with B-ALL. J Clin Oncol 2021; 39: 1650-59.
2. Shah BD, Ghobadi A, Oluwole OO, et al. KTE-X19 for relapsed or refractory adult B-cell acute lymphoblastic leukaemia: Phase 2 results of the single-arm, open-label, multicentre ZUMA-3 study. Lancet 2021; 398: 491-502.
3. Shah NN, Highfill SL, Shalabi H, et al. CD4/CD8 T-cell selection affects chimeric antigen receptor (CAR) T-cell potency and toxicity: Updated results from a phase I anti-CD22 CAR T-cell trial. J Clin Oncol 2020; 38: 1938-50.
4. Pan J, Zuo S, Deng B, et al. Sequential CD19-22 CAR T therapy induces sustained remission in children with r/r B-ALL. Blood 2020; 135: 387-91.
5. Pan J, Niu Q, Deng B, et al. CD22 CAR T-cell therapy in refractory or relapsed B acute lymphoblastic leukemia. Leukemia 2019; 33: 2854-66.