人多能干细胞(hPSC)体外造血分化为研究人体正常造血发育提供了新模型,也为体外再生功能性血细胞用于临床血细胞治疗提供了新策略。但是由于缺乏对人造血发育过程中细胞及分子机制的深入了解,由hPSC体外再生的血细胞往往缺乏自然的正常的功能[1]。对体内外造血分化的细胞和分子机制进行深入的探索和比较,有望帮助找到新的策略用于体外再生功能性血细胞。
2021年9月3日,中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛、王建祥团队,约翰·霍普金斯大学医学院王征宇团队以及中山大学医学院李昕团队联合在《Science Advances》期刊在线发表题为“Single-cell transcriptome of early hematopoiesis guides arterial endothelial-enhanced functional T cell generation from human PSCs”的研究论文。该研究完整绘制了人多能干细胞早期造血分化转录图谱,并揭示了体外再生功能性T细胞的新策略。

作者通过前期的优化成功建立了一套无血清,无基质细胞共培养,化学成分明确的hPSC体外单层造血分化体系[2-4]。在此分化体系基础上,选取了分化第0天细胞(hPSC阶段)、 第2天细胞(中胚层阶段)、第4天细胞(内皮阶段)和第6天细胞(造血祖细胞阶段)进行10×Genomics单细胞测序。研究人员首先从整体上构建了hPSC造血转变的整个转录组图谱,揭示了顺序性的转录信号激活在hPSC逐级造血转变中发挥关键的调节作用。拟时分析发现,内皮造血细胞并不直接起源于中胚层,而是来自于中胚层之后早期的间质细胞。通过进一步研究,一群具有内皮造血分化倾向的间质细胞也在随后的研究中被鉴定出来,这些发现为探究造血起源提供了新线索。
鉴于内皮造血转变(EHT)是造血发育的关键阶段,随后作者聚焦EHT过程,全面解析了EHT阶段的细胞及分子表达谱。首先,鉴定出了EHT阶段不同的微环境群体及造血群体,包括动脉内皮、静脉内皮、间质细胞,生血内皮细胞及造血祖细胞。通过配体受体分析,进一步揭示了微环境群体与造血群体之间复杂的相互作用关系,其中,动脉内皮与生血内皮/造血祖细胞之间的作用关系高度富集于Notch信号上。在机制上,作者通过与体内胚胎,胎肝及骨髓数据相比较,发现体外EHT尽管处于氧代谢逐渐下调的过程,但相比体内仍处于活跃的有氧代谢状态。在功能上,发现了在EHT阶段使用低氧培养能显著促进造血祖细胞再生。这些发现提示有氧代谢信号的下调是EHT阶段的重要分子特征。此外,在EHT阶段,还发现伴随着低氧代谢信号的上升,动脉化相关的信号基因也显著被激活,而抑制动脉内皮的发育则显著损害造血祖细胞再生,这些提示低氧可能通过促进动脉化增强造血分化。
为了进一步探究微环境群体的功能作用,作者分离出了不同的微环境组分及造血组分,通过相互共培养,最终发现自体来源的动脉内皮细胞能显著促进动脉化的生血内皮细胞向具有T系分化倾向的造血祖细胞转变。在该过程中,抑制Notch信号显著抑制造血祖细胞及T细胞生成,提示动脉内皮可能通过Notch信号促进造血发育。最后,为了进一步评估经动脉化来源的造血祖细胞的功能作用,作者以T细胞分化为切入点,联合嵌合抗原受体(CAR)技术,构建了hPSC来源的 CD19-CAR-T细胞,通过体内外评估最终发现hPSC-CAR-T具有与外周血T细胞类似的肿瘤杀伤效应。
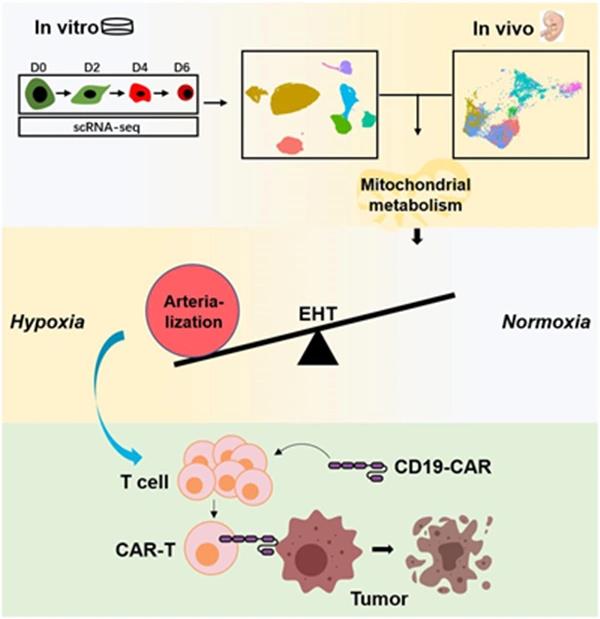
总之,该工作为进一步研究人的造血发育规律奠定了重要基础,同时也为体外再生功能性T细胞用于临床治疗提供了一条重要途径,显示了较大的转化潜力。
中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛教授、王建祥教授,约翰·霍普金斯大学医学院王征宇博士以及中山大学医学院李昕教授是本文的通讯作者。中国医学科学院血液病医院(中国医学科学院血液学研究所)助理研究员沈俊、副研究员徐颖茜、博士研究生张朔及吕淑珍为本文的共同第一作者。
参考文献:
1. M. Hansen, M. von Lindern, E. van den Akker, E. Varga, Human-induced pluripotent stem cell-derived blood products: state of the art and future directions. FEBS letters 593, 3288-3303 (2019).
2. J. Shen, C. Lyu, Y. Zhu, Z. Feng, S. Zhang, D. L. Hoyle, G. Ji, R. A. Brodsky, T. Cheng, Z. Z. Wang, Defining early hematopoietic-fated primitive streak specification of human pluripotent stem cells by the orchestrated balance of Wnt, activin, and BMP signaling. Journal of cellular physiology 234, 16136-16147 (2019).
3. J. Shen, Y. Zhu, C. Lyu, Z. Feng, S. Lyu, Y. Zhao, D. L. Hoyle, G. Ji, W. Miao, X. Zhang, L. Cheng, R. A. Brodsky, T. Cheng, Z. Z. Wang, Sequential cellular niches control the generation of enucleated erythrocytes from human pluripotent stem cells. Haematologica 105, e48-e51 (2020).
4. J. Shen, Y. Zhu, S. Zhang, S. Lyu, C. Lyu, Z. Feng, D. L. Hoyle, Z. Z. Wang, T. Cheng, Vitronectin-activated alphavbeta3 and alphavbeta5 integrin signalling specifies haematopoietic fate in human pluripotent stem cells. Cell proliferation 54, e13012 (2021).
撰稿:沈 俊 高佳佳
编辑:柴子越
校对:董 源
审核:祁健伟