(二)抑制物检测方法
抑制物的功能试验是将患者血浆和含FVIII或FIX的正常人混合血浆中的因子活性与稀释液和正常人对照混合血浆中的因子活性进行比较,这两种混合物需同时制备和孵育(图1)。对于FVIII抑制物来说,需要孵育一定的时间;FIX抑制物,则不需要孵育。FVIII或FIX的来源通常是正常人的混合血浆(NPP),有时也使用治疗产品;而重组FVIII由于缺乏VWF,不能产生与血浆同等的结果。猪源性FVIII已作为FVIII的来源用于检测与该产品有交叉反应的抑制物。患者混合物中残留的因子活性除以对照血浆混合物的因子活性,再乘以100,得到剩余活性的百分比 (RA),它可转换为任意单位的抑制物。已发表的抑制物检测方法在抑制物单位的定义、孵育时间、试剂组成等检测方法方面有所不同。有三种方法已用于FVIII抑制物试验:一步凝固法,两步凝固法和两步显色法。对于FIX抑制物,最常用的是一期凝固法。高滴度抑制物必须在试验前进行稀释。
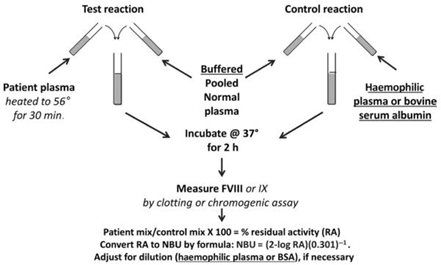
图1 基于1975年Bethesda法的CDC Nijmegen-Bethesda示意图,下划线为改良Nijmegen法,斜体为改良CDC法。
1. 凝固法为基础的功能试验
1959年,Biggs和Bidwell首次描述了两步凝固法测定FVIII抑制物,孵育时间1小时,将灭活75%的FVIII活性定义为一个抑制物单位。1975年,研究人员在马里兰州Bethesda会议中对美国使用的抑制物试验提出了标准化,将1 Bethesda单位(BU)定义为1毫升(mL)患者血浆在37℃下孵育2小时灭活等量NPP的50% FVIII活性的抑制物的量(图1)。使用一步凝固法定量检测与NPP等比例混合的患者血浆及与咪唑缓冲液等比例混合的NPP血浆的FVIII活性,两者比值%RA可用于BU计算。这种“Bethesda试验”(BA)逐渐在国际上被采用,而使用两步法测定FVIII的方法不再流行。这种方法直到1995年才有了改变,Verbruggen和他同事提出了2项修改措施:(i)使用咪唑缓冲NPP,(ii)在对照混合物中使用缺乏FVIII的血浆(FVIIIDP),并用于稀释高滴度抑制物血浆。这些修改(如图1所示)旨在稳定孵育期间混合物的蛋白浓度和pH值。在877份标本中,相比BA,改良后的方法减少了低滴度阳性结果,称为改良Nijmegen法或Nijmegen-Bethesda法(NBA),该方法得到了国际血栓和止血学会(ISTH)的认可,并成为抑制物检测的“金标准”。2012年,CDC调查人员证实可对患者血浆进行分析前热处理(PHT)来去除因子,从而对最近接受治疗或常规使用FVIII或FIX产品进行预防或ITI的患者进行准确检测。这种CDC改良的NBA法(CDC-NBA),如图1所示,被用于测试FVIII和IX抑制物延用至今。
2. 显色法功能试验
使用凝固法测定因子的抑制物试验有一定的局限性,纤维蛋白凝块的形成取决于许多变量,并且可能受普通肝素、狼疮抗凝物和儿童常见的非特异性凝血抑制物的干扰。通常很难将这种凝血抑制物与真正的因子抑制物区分开。由于使用显色底物法对FVIII进行检测具有更精确的终点,即Xa因子的裂解,因此Blanco等人建议将其用于抑制物检测。显色法提高了检测的准确性。显色法Bethesda试验(CBA)除了使用显色基团测定FVIII外,其他方面与之前描述的CDC-NBA是一样的。1005例标本同时进行CDC-NBA和CBA检测,在883例NBA阴性标本中有0.3% 的标本CBA为阳性;80例0.5-1.9NBU阳性标本中有54% 的标本CBA为阳性;42例≥2.0NBU的标本中,,CBA阳性率为100%。使用荧光免疫分析(FLI)识别IgG和IgM型抗FVIII抗体,在51例CBA阳性标本中FLI阳性的有50例(98%),而在103例NBA阳性标本中FLI阳性的仅84例(82%)(P=.004),这表明CBA更能提示特异性抗FVIII抗体的存在。CDC-NBA、CBA和FLI对阴性标本和≥2.0 NBU标本结果大体一致;然而,在0.5-1.9 NBU的样本中,26%的样本在CBA中抑制物阴性,这表明观察到的抑制物不是FVIII特异性的,结果为假阳性,一些抗体已被证明是非时间依赖性的。对于≥2.0 NBU的标本,CDC-NBA与CBA结果的相关性极好(r =0.98, P< 0.0001)。FIX显色法不能用于抑制物检测。美国食品和药物管理局(FDA)尚没有批准商品化显色法FIX检测试剂用于临床。FIX CBA用于确定血友病B患者有LA而不是特定的FIX抑制剂。尽管显色法通常被认为比凝固法检测凝血因子活性更昂贵,但在抑制物试验中使用的显色法可能会减少假阳性的结果以及额外的检测。改变显色检测试剂的包装量或验证冷冻后试剂的性能可以降低测试成本,使其与凝固试剂相等甚至更低。
3.抗体检测试验
检测FVIII和FIX抗体的方法包括酶联免疫吸附试验(ELISA)、免疫沉淀试验(IP)、荧光免疫试验(FLI),它们能够同时测量抑制性抗体和非抑制性抗体,所以,这些方法不等同于也不能取代功能性抑制物测定试验。这些方法可用于筛选需要进行抑制物测定的标本或确认特异性抗体的存在。它们比功能分析更灵敏,FLI能够检测稀释到0.03 NBU的FVIII抑制物。商品化的酶联免疫吸附试剂盒(ELISA)可以测量与固定在塑料表面的FVIII结合的IgG抗体。FLI检测能与固定在荧光微粒上的FVIII或FIX结合的抗体。它的多重检测功能允许在一次测试中可以评估出抗FVIII或抗FIX的免疫球蛋白亚型。综上所述,FVIII的功能性抑制物与IgG4亚型的抗FVIII抗体相关。抑制物阴性和抑制物阳性患者中均存在IgG1抗体;初步的证据表明,IgG1抗体出现较早,可以预测HA中抑制物的变化趋势,并且在高滴度抑制物减少时仍然存在。商品化抗FVIII ELISA试剂盒在一些LA阳性的非血友病患者中也检测到了抗体,然而并未报道IgG的亚型。通过ELISA和FLI检测,FIX抑制物同样与IgG4型抗FIX抗体的存在相关。
在接下来的两期内容,我们继续为大家介绍(三)近年来的试验改良、(四)质量控制等两方面内容。敬请期待!
参考文献
Miller CH. Laboratory testing for factor VIII and IX inhibitors in haemophilia: A review. Haemophilia. 2018 Mar; 24(2):186-197.