近日,中国医学科学院血液病医院(中国医学科学院血液学研究所)邵英起和中山大学肿瘤医院梁洋合作在《Leukemia》(IF=11.4)在线发布了题为“Challenges in Analyzing Clinical Trials Testing Bruton Tyrosine-Kinase-Inhibitora in Chronic Lymphocytic Leukaemia”的研究论文。
该研究从开放标签设计,试验开始后研究的进入标准、行为、终点和/或分析的变化,最佳中位无进展生存期(PFS)和/或生存率的表示方法[1],PFS是否为最佳替代终点[2],不同慢性淋巴细胞白血病(CLL)临床研究结果的一致性评价,PFS等终点的亚组分析结果,微小残留病灶阴性(uMRD)是否为最佳替代终点[3],以及研究信息审查等多个方面进行剖析,揭示CLL研究设计中应该遵循的基本客观原则,让研究结果真正反映出药物本身带来的生存获益。
美国食品药品监督管理局(FDA)批准了伊布替尼在内的4种布鲁顿氏酪氨酸激酶抑制剂(BTKi)用于CLL治疗,但药物研究设计和解读仍然存在挑战及争议,研究者审查了10项研究以阐明以下问题。
如果临床研究选择非盲态的开放标签设计,可能会来带来安全性和疗效评估的偏倚[4]。如ELEVATE-RR和ALPINE研究中,非盲态的开放标签设计可能带来评估毒副反应的主观偏差,在评估疗效时会产生主观判断的偏倚和不合理的治疗药物减停或转换;研究进行中更改主要终点等容易导致结果倾向性改变[5];非预设的期中分析也会导致研究者/患者对疗效和安全性产生误判,引入偏倚[6]。此外,当中位PFS/总生存期(OS)置信区间宽时易被高估,而RMPFST/RMST置信区间较PFS/OS窄且稳定,推荐研究中应更多使用[1]。
既往化学免疫治疗CLL的临床研究中,PFS和OS结果显示基本一致[2]。而在ALLIANCE、SEQUOIA及ELEVATE-TN等BTKi的新药研究中,由于PFS时间短,更易被研究者/申办方设为主要研究终点,导致BTKi带来PFS获益,但OS无获益。鉴于OS才是患者获益的金标准,FDA建议将OS纳入共同主要终点[7]。此外,不同研究结果应考虑其结果的一致性问题,如在RESONATE中,伊布替尼组患者不良预后因素较ALPINE中的伊布替尼组患者比例高,但RESONATE的伊布替尼组患者的PFS反而更长且治疗中断更少。同时ELEVATE-RR中伊布替尼组的疗效与RESONATE一致,显示了ALPINE可能会由于设计的欠缺带来结果的偏差和误解读[8]。
多数CLL的临床研究无法得出亚组的显著差异,很难预测亚组患者是否受益于某一种BTKi[9],使用多因素的机器学习或RSF模型可能有助于个体化治疗。微小残留病灶(MRD)检测虽能测算出导致复发的残留CLL细胞数,但受检测策略尚不完美等的影响,导致MRD未必能真正反应出疾病状态,此外,uMRD和PFS之间相关性在化学免疫治疗和BTKi治疗中的结果不一致,故MRD是否可以用于替代终点仍有争议[3]。另外,不同密集程度的信息审查或早期删失(可评估患者的丢失)也会带来疗效评估的偏倚[10]。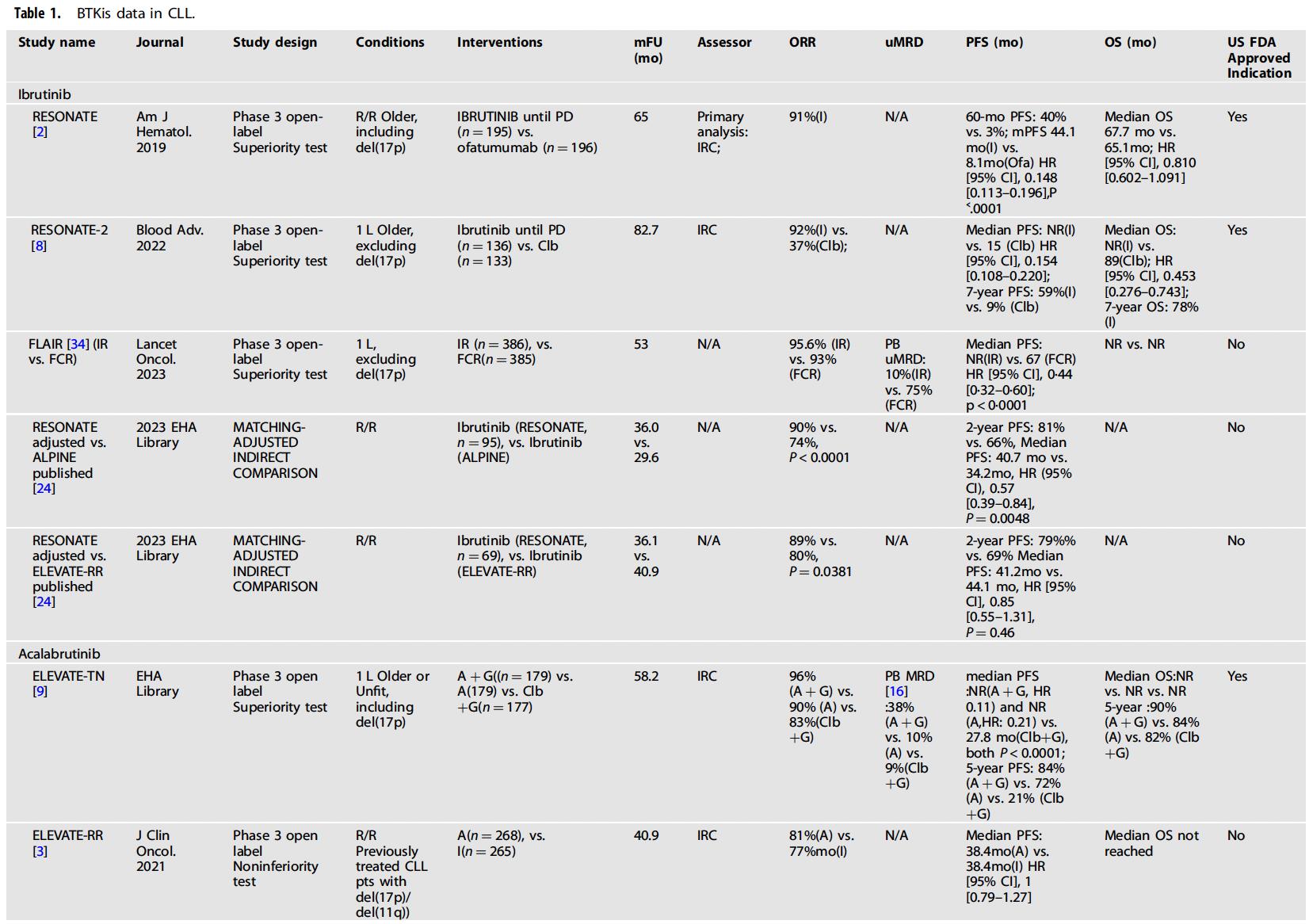
综上,该研究通过深入分析前瞻性临床研究的研究设计和结果解读,揭示研究设计的一些客观原则,为严谨设计和解读临床研究提供思路,对于提升临床研究质量具有重要意义。
中国医学科学院血液病医院(中国医学科学院血液学研究所)邵英起主任医师和中山大学附属肿瘤医院梁洋主任医师(所院兼职研究员)为共同通讯作者,美国梅奥诊疗中心Neil E. Kay教授和帝国理工大学Robert Peter Gale教授为重要贡献作者。
参考文献:
1. Das A, Lin TA, Lin C, Meirson T, McCaw ZR, Tian L, et al. Assessment of median and mean survival time in cancer clinical trials. JAMA Netw Open. 2023;6:e236498
2. Beauchemin C, Johnston JB, Lapierre MÈ, Aissa F, Lachaine J. Relationship between progression-free survival and overall survival in chronic lymphocytic leukemia: a literature-based analysis. Curr Oncol. 2015;22:e148–56
3. Kipps TJ. Challenging the value of minimal residual disease in predicting outcome of patients with chronic lymphocytic leukemia. J Clin Oncol. 2023;41:3676–8.
4. Hróbjartsson A, Thomsen ASS, Emanuelsson F, Tendal B, Hilden J, Boutron I, et al. Observer bias in randomized clinical trials with measurement scale outcomes: a systematic review of trials with both blinded and nonblinded assessors. CMAJ. 2013;185:E201–11.
5. Florez MA, Jaoude JA, Patel RR, Kouzy R, Lin TA, De B, et al. Incidence of primary end point changes among active cancer phase 3 randomized clinical trials. JAMA Netw Open. 2023;6:e2313819.
6. Gale RP. Being certain even when you’re wrong: heuristics and thin slicing in haematopoietic cell transplantation. Bone Marrow Transpl. 2021;56:1223–6.
8. Ghia P, Munir T, Burger J, Seymour J, Rogers K, Huang HH, et al. P645: ibrutinib for treatment of relapsed-refractory chronic lymphocytic leukemia: a matchingadjusted indirect comparison of 3 randomized phase 3 trials. Hemasphere. 2023;7:e78258de.
9. Amatya AK, Fiero MH, Bloomquist EW, Sinha AK, Lemery SJ, Singh H, et al. Subgroup analyses in oncology trials: regulatory considerations and case examples. Clin Cancer Res. 2021;27:5753–6
10. Rosen K, Prasad V, Chen EY. Censored patients in Kaplan-Meier plots of cancer drugs: an empirical analysis of data sharing. Eur J Cancer. 2020;141:152–61.