2025年8月18日,中国医学科学院血液病医院(中国医学科学院血液学研究所)张孝兵研究员、张健萍副研究员团队在《Journal of Controlled Release》(IF=11.5)在线发表论文,报道经系统验证的“仿生膜纳米颗粒(LNP)”新范式:在统一剂量与工艺下,相较以二硬脂酰基磷脂酰胆碱(DSPC)为核心的经典四组分配方(辉瑞/Moderna同类架构),在肝细胞与血友病A小鼠模型中基因编辑效率提升约2-3倍,同时利用短暂mRNA表达降低Cas9长期表达的安全隐患。团队同期获LNP冷冻保护剂专利,解决冻融与储运稳定性难题,并贯通mRNA体外转录、加帽与Poly(A)工程、LNP制剂开发、质量控制到GMP放大与临床转化,构建体内基因编辑与mRNA药物化的可复制、可规模化技术底座。

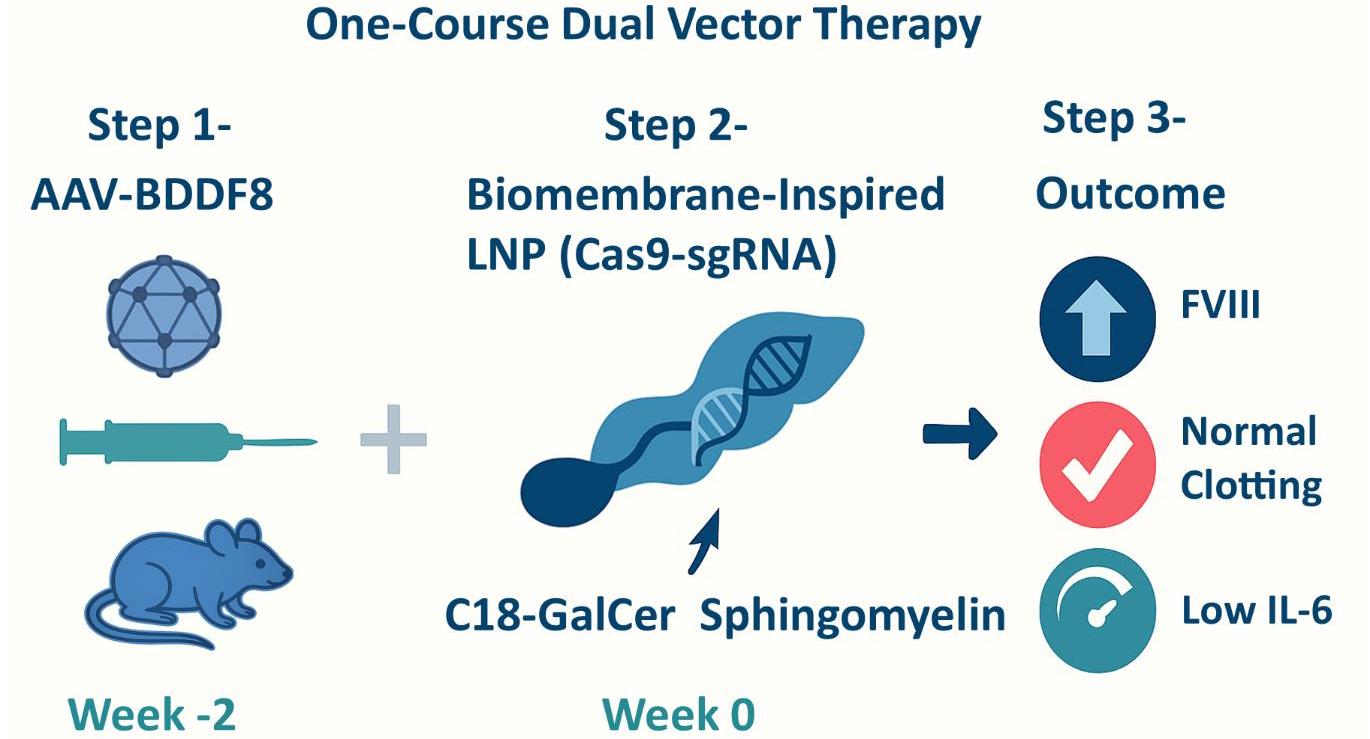
三句话看懂这项工作:1.更聪明的LNP“外衣”:6组分仿生膜LNP引入鞘磷脂、C18 GalCer与DOPE,优化膜流动性与内体逃逸,在细胞与动物模型中实现≈2-3倍效率提升。2.一次给药、长期受益:与AAV提供修复模板的“双载体”组合,在血友病A小鼠中将血浆FⅧ恢复至>50%并长期维持,未见明显毒性或脱靶。3.从“试验台”到“产线”:团队获LNP冷冻保护专利,已完成mRNA IVT—加帽/Poly(A)—LNP配方—质控—GMP—临床的全链路布局,确保“可生产、可监管、可临床”。
研究重点:LNP是改变疫情走向的“隐形功臣”。mRNA脆弱易降解,只有被安全送入细胞才能发挥作用;LNP正是这一“运力系统”的核心,使mRNA疫苗在新冠中得以快速研发、量产并全球部署,成为降低重症与死亡的关键。行业共识表明,离子化脂质、胆固醇、辅助磷脂与PEG脂决定了封装稳定性、循环时间与内体逃逸等性能;基于此的工程化与制造能力,使疫苗得以在短时间覆盖全球人群。
科普小贴士:LNP是“快递盒”,mRNA是“说明书”。LNP像给mRNA穿上的“外衣”,帮助其跨越血液循环、细胞膜与内体等关卡,把“说明书”安全送进细胞;到细胞达后,LNP在酸性内体环境中发生质子化与膜融合,像“撕开胶带”一样释放mRNA——真正的难点往往是这一步的内体逃逸。
团队工作内容:LNP“代际升级”。1.配方创新:不同于经典四组分LNP,本研究首创6组分仿生膜设计,将鞘磷脂与C18 GalCer纳入Cas9 mRNA/sgRNA递送体系,并配伍DOPE,模拟膜脂筏与曲率特性,兼顾稳定与相容性。2.性能跃迁:在肝细胞与血友病A小鼠中,编辑效率提高≈2-3倍;短时表达降低Cas9长期表达带来的免疫与脱靶风险。3.双载体策略:AAV提供F8修复模板+LNP递送CRISPR组件,单次给药即可使血浆FⅧ>50%并维持>12周,无明显毒性或脱靶。4.工艺与稳定性:团队获LNP冷冻保护专利(ZL202510265291.5),显著改善冻融与保存表现。
全产业链布局:从理念到临床。过去三年团队已完成从底层技术到转化应用的“端到端”布局:1.分子底座:mRNA IVT、高效加帽与可编程Poly(A)尾优化,建立纯化与残留标准。2.递送平台:仿生膜LNP库构建(含肝脏与免疫细胞靶向化策略)、工艺参数体系化与放大验证。3.质量控制:理化表征、包封率、内体逃逸与表达动力学评估,并结合长读长测序进行安全性与一致性检测。4.制剂工程:冷冻保护专利与稳定化策略,支持规模化生产、低温储运与成本控制。5.知识产权与生态:围绕Poly(A)与LNP的多项专利与论文布局,联动临床与产业伙伴,打造“平台型技术护城河”。
应用前景:从血友病A迈向更多疾病。1.肝脏遗传病:如F8/F9相关疾病,双载体策略提升精准修复与持久表达。2.体内免疫细胞工程:靶向LNP有望直接在体内实现T/NK细胞改造,推动CAR T/NK新模式,简化生产链、降低成本。3.干细胞基因治疗:结合LNP mRNA与基因编辑,改造造血/间充质等干细胞,面向罕见病与再生医学。
中国医学科学院血液病医院(中国医学科学院血液学研究所)张孝兵研究员和张健萍副研究员为共同通讯作者。中国医学科学院血液病医院(中国医学科学院血液学研究所)博士研究生赵娟娟、细胞生态海河实验室硕士研究生田赛宁和彭祖怡为共同第一作者。该项目获得国家重点研发计划、国家自然科学基金、中国医学科学院医学与健康科技创新工程基金和细胞生态海河实验室创新基金等的支持。
参考文献:
1. Hou X, Zaks T, Langer R, Dong Y. Lipid nanoparticles for mRNA delivery. Nat Rev Mater. 2021;6:1078 1094.
2. Chatterjee S, et al. Endosomal escape: A bottleneck for LNP mediated therapeutics. Proc Natl Acad Sci USA. 2024;121:e2307800120.
3. Chen H, et al. Hemophilia A ameliorated in mice by CRISPR based in vivo genome editing of human Factor VIII. Sci Rep. 2019;9:16838.
4. Nguyen GN, et al. A long term study of AAV gene therapy in dogs with hemophilia A identifies clonal expansions of transduced liver cells. Nat Biotechnol. 2021;39:47 55.
5. Wang D, Tai PWL, Gao G. Adeno associated virus vector as a platform for gene therapy delivery. Nat Rev Drug Discov. 2019;18:358 378.
6. Schoenmaker L, et al. mRNA lipid nanoparticle COVID 19 vaccines: Structure and stability. Int J Pharm. 2021;601:120586.
7. Raguram A, Banskota S, Liu DR. Therapeutic in vivo delivery of gene editing agents. Cell. 2022;185:2806 2827.