2020年10月27日,中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛/程辉课题组与上海交通大学医学院郑俊克课题组合作在《The Journal of Clinical Investigation》杂志发表了题为“ANGPTL2-containing small extracellular vesicles from vascular endothelial cells accelerate leukemia progression”的研究论文。

细胞外小囊泡(small extracellular vesicles,SEV)是重要的细胞间通讯介质,目前已有研究表明其在白血病发生发展中起到重要作用。但是由于标记策略及分辨率的限制,微环境细胞来源的细胞外小囊泡在体内的作用很少被报道。
为了阐明哪种微环境来源的SEV对白血病的发展更为重要,该研究使用了7种微环境细胞类型特异性的Cre小鼠。其中包括Cdh5-Cre、Tie2-Cre、Cdh5-CreER、LepR-Cre、Osx-CreER、Pf4-Cre和Tcf21-CreER。通过与Vps33b Flox小鼠杂交来条件性地敲除内皮细胞(EC)、骨髓间充质干细胞、成骨祖细胞、巨核细胞和脾脏间质细胞中的Vps33b基因,以达到减少上述细胞SEV分泌的目的。在此基础上探究了特定类型微环境细胞SEV分泌减少对MLL-AF9诱导的急性髓系白血病(AML)发病的影响,以及对正常造血和造血干细胞功能的影响。数据显示,减少内皮细胞来源的SEV(EC-SEVs)能够显著地延缓白血病小鼠的发病进程,提高小鼠生存期。而减少内皮细胞分泌的SEV却几乎不对正常造血产生影响。通过对内皮细胞分泌的SEV进行蛋白质谱分析,发现EC-SEV中含有高丰度的ANGPTL2(A2)蛋白。而内皮细胞分泌包含A2的SEV(A2-SEV)这一过程受到VPS33B蛋白的调控。进一步研究证明A2-SEV通过与白血病细胞上LILRB2受体结合从而影响了白血病细胞功能及加速了白血病的进展。更为重要的是,A2-SEV 和EC-SEV同样可以增强病人原代AML 细胞的功能。
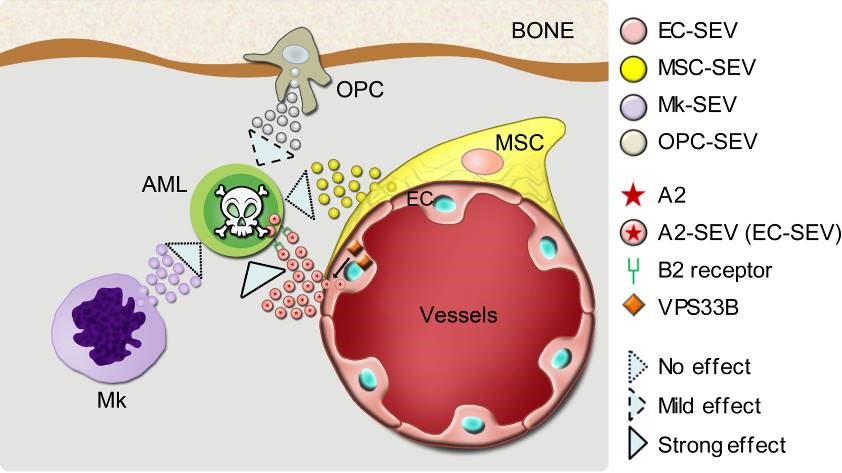
总的来说,该研究首次系统性地探索了体内特定微环境细胞来源的细胞外小囊泡在白血病进展中的作用。证明了在不同细胞类型中缺失Vps33b可以有效地减少SEV的分泌,为探索SEV的体内功能和其携带的功能蛋白鉴定提供了可参考的思路和模型。重要的是,该工作提示ANGPTL2-SEV可能是干预某些类型AML的潜在靶点。血研所博士生孙国欢、上海交通大学医学院博士生黄丹、郝晓鑫和赫肖肖为并列第一作者。血研所程涛教授、程辉副研究员和上海交通大学医学院郑俊克教授为共同通讯作者。中科院分子细胞科学卓越创新中心周波教授提供了大力支持。该研究得到了科技部、基金委和医科院创新工程等基金的支持。
原文链接:https://www.jci.org/articles/view/138986
撰稿:程辉
编辑:董源
校对:李宝翔
审核:祁健伟、周家喜