造血干细胞(HSC)移植是治疗各种恶性血液系统疾病及免疫功能障碍的重要手段。目前临床上在进行HSC移植时,仍需要对患者进行大剂量的放疗或化疗预处理。然而,大剂量放疗预处理在清髓的同时,会对植入的HSC产生“旁观者”效应(RIBE)损伤,即直接受到辐射的细胞通过信号转导引起未受到辐射的邻近细胞的损伤,从而不利于HSC的植入和长期造血重建。
程涛教授课题组前期的研究发现,在小鼠中辐射损伤受体环境对于供体移植HSC有负性作用的RIBE,从机制上可能与辐射损伤诱导过氧化物ROS升高,导致HSC下调c-kit表达有关(Blood,2012)。而采用抗氧化剂NAC或在HSC中过表达可清除ROS的过氧化氢酶,可以显著增强移植到照射后小鼠体内的HSC的功能(Molecular Therapy,2013;Blood,2014)。而RIBE对人HSC的影响及其分子机制的研究仍然是空白的。

2021年2月26日,中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛/姜尔烈团队在国际血液学权威期刊Blood在线发表了题为“Radiation-induced bystander effects impair transplanted human hematopoietic stem cells via oxidative DNA damage”的研究论文,揭示了辐射诱导的“旁观者”效应对人HSC长期造血重建、自我更新和HPC克隆形成能力的影响,并解析了其发生的分子机制及其干预策略。
研究者采用RIBE体内外模型发现,受到RIBE的人HSPC内ROS大量聚集,导致人HSPC的DNA损伤,线粒体功能障碍,ATP生成减少,代谢表型发生改变,有氧呼吸和无氧糖酵解减弱。HSC的长期造血重建能力、自我更新能力以及HPC的体外克隆形成能力下降。从机制上,受到RIBE的人HSPC胞内γ-H2AX表达升高,ATM-CHK2、ATR-CHK1信号通路激活,P53发生磷酸化;下游激活P21、P16、PUMA-Caspases,导致HSPC细胞周期发生阻滞,衰老和凋亡增加。体内和体外抗氧化药物(NAC,Sulforaphane,Resveratrol)干预均能不同程度地降低RIBE对人HSPC的损伤。
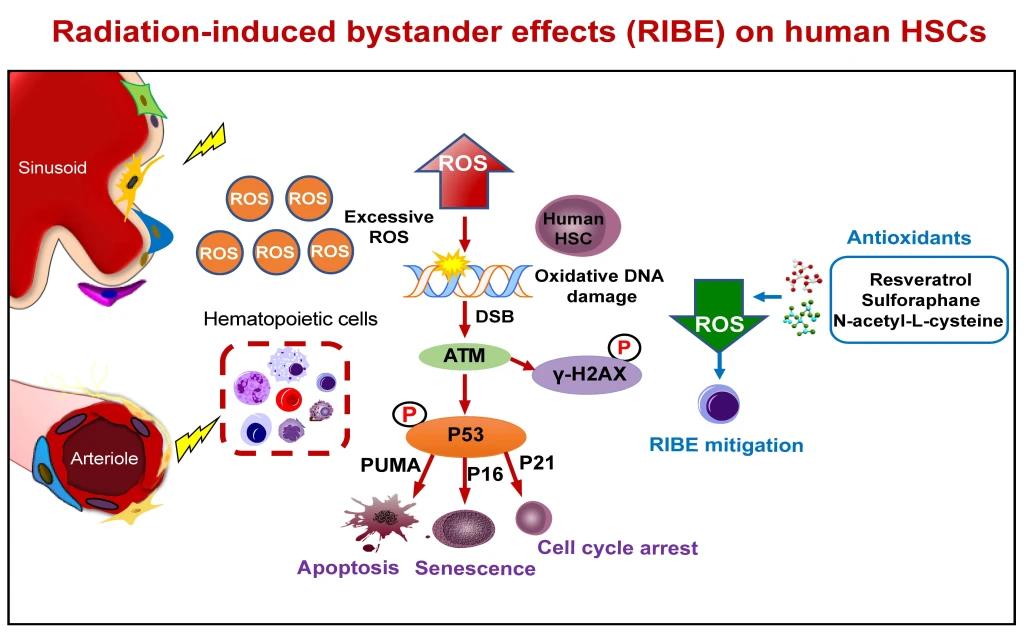
综上所述,该项研究首次揭示了RIBE对人HSPC的DNA损伤作用,填补了RIBE损伤人HSPC功能研究的空白,为临床上需要放疗预处理的骨髓移植患者制定有效的治疗方案提供了一定的理论基础。
中国医学科学院血液病医院(中国医学科学院血液学研究所)实验血液学国家重点实验室程涛教授和干细胞移植中心姜尔烈主任为该论文的通讯作者,副研究员胡林萍、博士生尹秀秀、张雅文、干细胞移植中心庞爱明主任医师为本文的共同第一作者。
撰稿:张雅文 胡林萍 庞爱明
编辑:柴子越
校对:董 源
审核:祁健伟 周家喜