造血干细胞(HSC)被认为是实现基于HSC的细胞治疗的基础,限制其临床应用的主要瓶颈为HSC数量不足及由于HSC功能缺陷导致移植后特定谱系尤其是巨核系的重建失败[1]。因此,高质高效的HSC扩增对实现基于HSC的细胞治疗的广泛应用尤其重要,也是造血领域的关键技术和研究热点。国内外不同团队报导了基于小分子化合物(如SR1[2]、UM171[3])、多肽(NOV[4])、高分子聚合物(PVA[5])等多种HSC体外扩增策略,然而这些工作并未考察其对HSC巨核系重建能力的影响。Carrelha, J等在小鼠造血干细胞异质性群体中发现存在巨核偏向造血干细胞(Mk-biased HSC),并解析了其免疫表型[6],然而,在人造血系统中Mk-biased HSC存在与否及其免疫表型仍然是个未解之谜。
2023年4月18日,中国医学科学院血液病医院(中国医学科学院血液学研究所)高瀛岱、施均、程涛和清华大学杜亚楠合作在《Nature Communications》(IF=17.694)在线发布了题为“Expansion of Human Megakaryocyte-biased Hematopoietic Stem Cells by Biomimetic Microniche”的研究论文。此研究建立了基于仿生微环境载体的人HSC的扩增策略,实现了不同来源的HSC的体外扩增,同时揭示了人造血系统中Mk-biased HSC的存在,解析了该亚群的免疫表型,提出Mk-biased HSC体外扩增体系,为造血干细胞体外扩增和异质性研究提出了新的观点。

该研究制作了在刚性、孔径大小、材料等方面仿生骨髓微环境的仿生微载体,将之添加到细胞培养体系中,发现该体系能以包括脐带血(UCB)CD34+细胞,及UCB、外周血(PB)和骨髓(BM)单核细胞(MNC)在内的多种来源细胞为原料,扩增较原始的HSC亚群(免疫表型为:CD34+CD38-CD45RA-CD90+和CD34+CD38-CD45RA-CD90+CD49f+)。通过极限稀释移植实验得出,Microniche将功能性造血干细胞扩增了5.01倍。经该体系培养的再生障碍性贫血(AA)患者来源的骨髓MNC可重新恢复已丧失的免疫缺陷小鼠体内造血重建能力。接下来,在生物反应器内应用该扩增策略后,实现了UCB MNC为起始细胞的HSC体外规模化扩增,功能性干细胞扩增达7.39倍。
该研究进一步检测了Microniche对巨核造血的影响,发现在极限稀释移植中,成功植入的受体小鼠,淋系(Ly)和髓系(My)几乎全部重建,而仅有不到1/2的受体小鼠能够重建巨核系(Mk),表明具有重建Mk的HSC是功能性HSC中更小的一个细胞亚群,提示了人Mk-biased HSC的存在。培养基对照组的小鼠几乎无法重建Mk,表明传统培养条件下Mk-biased HSC容易丧失。而经过极限稀释计算,发现Microniche将Mk-biased HSC扩增了3.36倍。经过单细胞测序分析,发现Microniche培养后的特有细胞亚群的特征性基因为SELL(CD62L)和PROM1(CD133)。流式分析也证实了Microniche存在CD34+CD38-CD45RA-CD90+CD49flowCD62L-CD133+的独特细胞亚群。通过分选该亚群(CD62L-CD133+)和非该亚群(non-CD62L-CD133+)进行移植实验,证实了CD62L-CD133+亚群负责Mk的重建,而non-CD62L-CD133+负责其他系重建,表明人Mk-biased HSC富集于CD62L-CD133+亚群中。
该研究发现细胞因子微环境的重塑和合理仿生提供的物理支持对于该体系扩增人HSC十分关键。Microniche的产物细胞中细胞因子-细胞因子受体通路被激活,单细胞测序显示体系的产物细胞中存在特有的CD4阳性细胞亚群,该亚群通过细胞因子-细胞因子受体与其他亚群存在广泛的细胞间交流。不同刚性、孔径和材料的多种载体对比显示,只有合理仿生了骨髓细胞龛时才能够扩增HSC,且原始HSC和Mk-biased HSC更多的定位于Microniche内部,表明HSC和Mk-biased HSC扩增需要仿生细胞龛的物理支持。
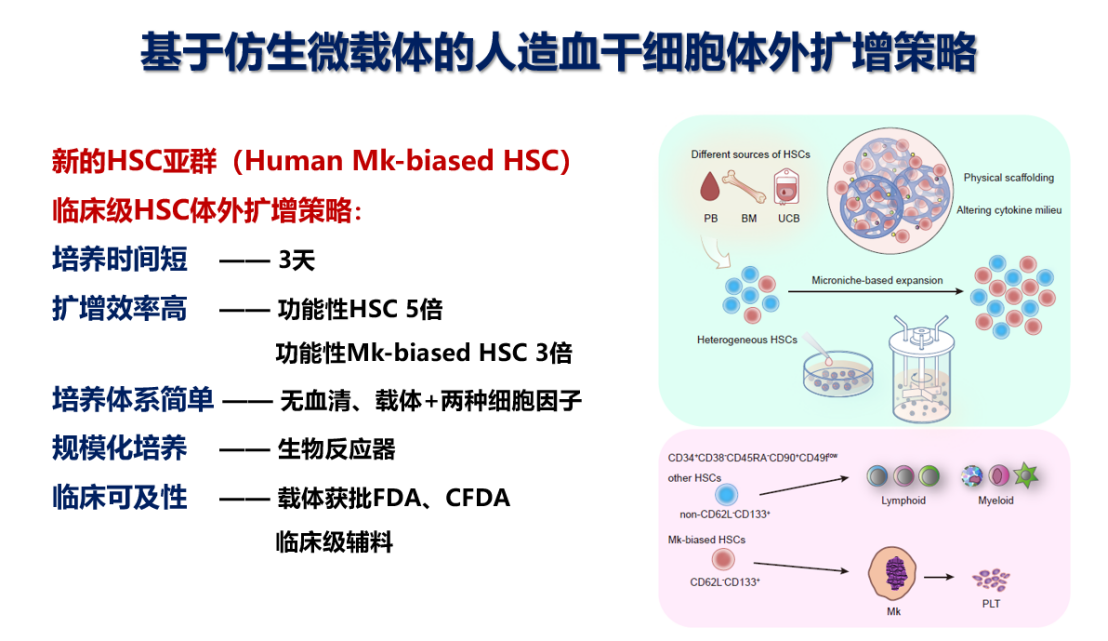
该研究研发了基于仿生微载体的人Mk-biased HSC体外扩增技术,揭示了人Mk-biased HSC免疫表型以及仿生物理支撑对原始HSC和Mk-biased HSC体外扩增的重要作用,为建立临床级HSC体外扩增策略打开了思路,对基于HSC的细胞治疗的广泛应用具有重要意义。
中国医学科学院血液病医院(中国医学科学院血液学研究所)高瀛岱研究员、施均主任医师、程涛教授和清华大学杜亚楠教授为共同通讯作者。中国医学科学院血液病医院(中国医学科学院血液学研究所)李迎辉副研究员、博士生何媚、张文姗技师、博士生徐惠和北京华龛生物科技有限公司CEO刘伟博士为共同第一作者。该项目获得国家重点研发计划、国家自然科学基金、中国医学科学院医学与健康科技创新工程以及细胞生态海河实验室创新基金等的支持。
参考文献:
1. Huang, X., Guo, B., Capitano, M. & Broxmeyer, H. E. Past, present, and future efforts to enhance the efficacy of cord blood hematopoietic cell transplantation. F1000Res 8 (2019).
2. Boitano, A. E. et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells. Science 329, 1345-1348 (2010).
3. Fares, I. et al. Cord blood expansion. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal. Science 345, 1509-1512 (2014).
4. Gupta, R. et al. Nov/CCN3 Enhances Cord Blood Engraftment by Rapidly Recruiting Latent Human Stem Cell Activity. Cell stem cell 26, 527-541 e528 (2020).
5. Wilkinson, A. C. et al. Long-term ex vivo haematopoietic-stem-cell expansion allows nonconditioned transplantation. Nature 571, 117-121 (2019).
6. Carrelha, J. et al. Hierarchically related lineage-restricted fates of multipotent haematopoietic stem cells. Nature 554, 106-111 (2018).