急性髓系白血病(AML)是一种血液系统恶性疾病,其特征是造血干/祖细胞(HSPC)恶性克隆性增殖及分化阻滞,成熟血细胞减少,导致患者骨髓衰竭乃至死亡[1]。白血病下的异常细胞间通讯在疾病发生发展中具有关键作用。细胞外小囊泡(sEV)作为重要的细胞间通讯方式,是近几年领域的研究热点[2]。中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛/程辉团队在之前的工作中报道了骨髓内皮细胞来源的sEV调控AML发生发展的分子机制[3],但目前针对白血病细胞来源的sEV及其内容物如何调控白血病细胞自身及如何影响正常造血细胞尚不清楚。
近日,中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛/程辉团队在《Haematologica》(IF=10.1)在线发表了题为“Small extracellular vesicles derived from acute myeloid leukemia cells promote leukemogenesis by transferring miR-221-3p”的文章。该研究揭示了AML细胞来源的sEV(AML-sEV)中含有高丰度的miR-221-3p,且在AML发生发展中起到了关键调控作用,为阐明AML发病机制提供了理论依据及潜在的治疗靶点。

该研究首先分离了小鼠AML细胞来源的sEV,通过小RNA测序发现miR-221-3p在AML-sEV中高表达。重要的是,在AML患者的外周血sEV中也检测到高丰度的miR-221-3p。接下来,功能实验证实AML-sEV通过传递miR-221-3p促进AML细胞的增殖,加速AML小鼠的疾病进程,该过程主要通过促进AML细胞进入细胞周期以及抑制细胞凋亡的方式实现。而靶向miR-221-3p可有效抑制AML细胞,延长白血病小鼠生存。miR-221-3p促进白血病细胞增殖这一现象可在多种白血病细胞系中重现。在机制上,发现miR-221-3p能够靶向Gbp2基因,调节Gbp2的表达从而调控PI3K-AKT通路,进而发挥促进AML细胞增殖的作用。此外,该研究提示AML-sEV及其包含的miR-221-3p也参与了AML下造血干细胞红系分化的抑制。
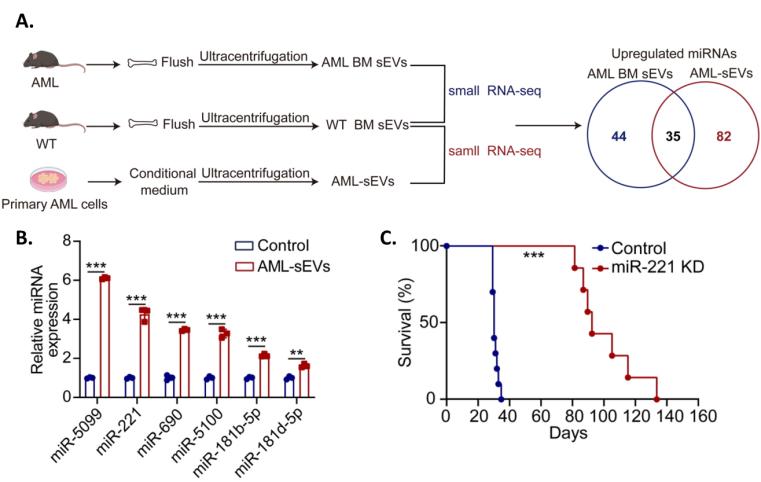
综上,该研究探索了AML-sEV在白血病进展中的重要作用,提示miR-221-3p有望成为新的分子标志物以及AML治疗的潜在靶点,为AML发病机制研究提供了新的思路。
中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛教授、程辉研究员、杨尚达副研究员和云南省第一人民医院王娅婕副主任医师为共同通讯作者,天津医科大学博士生李孟宇、中国医学科学院血液病医院(中国医学科学院血液学研究所)博士后孙国欢和云南省第一人民医院规培医师赵进莲为共同第一作者。该研究获得国家重点研发计划、国家自然科学基金、中国医学科学院医学与健康科技创新工程和细胞生态海河实验室创新基金等的支持。感谢中国医学科学院血液病医院(中国医学科学院血液学研究所)王建祥/王敏课题组在文章返修过程中提供的帮助。
参考文献:
1. Shallis RM, Wang R, Davidoff A, Ma X, Zeidan AM. Epidemiology of acute myeloid leukemia: Recent progress and enduring challenges. Blood reviews. 2019;36:70-87.
2. Sun G, Gu Q, Zheng J, Cheng H, Cheng T. Emerging roles of extracellular vesicles in normal and malignant hematopoiesis. The Journal of clinical investigation. 2022;132(18).
3. Huang D, Sun G, Hao X, He X, Zheng Z, Chen C, et al. ANGPTL2-containing small extracellular vesicles from vascular endothelial cells accelerate leukemia progression. The Journal of clinical investigation. 2021;131(1).