新型冠状病毒病(COVID-19)与糖尿病之间存在密切联系[1]。美国疾病控制与预防中心(CDC)的研究报告称,与未患新冠肺炎的人相比,18岁以下患有新冠肺炎的人更倾向于新发糖尿病[2]。自新冠疫情爆发以来,1型糖尿病(T1D)和2型糖尿病(T2D)的发病率显著上升。除了新冠病毒(SARS-CoV-2)外,多项研究还发现病毒感染与T1D之间存在关联[3],包括肠道病毒[4]、轮状病毒[5]、腮腺炎病毒[6]和巨细胞病毒[7]等。该研究团队在前期工作中构建了人多能干细胞向三胚层多种组织细胞及类器官分化的平台,对这些分化得到的细胞和类器官进行SARS-CoV-2感染,首次鉴定并报道了胰腺内分泌细胞可被SARS-CoV-2感染[8]。除了病毒直接感染导致的组织细胞损伤外,炎症引起的组织细胞损伤在新冠患者的疾病进程中同样起着关键作用。然而,目前尚缺乏合适的人类疾病模型来研究免疫细胞在病毒感染过程中对组织损伤的影响。
2024年9月3日,中国医学科学院血液病医院(中国医学科学院血液学研究所)杨柳柳研究员与康奈尔大学威尔医学院Robert E. Schwartz教授、陈水冰教授合作在《Cell Stem Cell》在线发布了题为“Human Vascularized Macrophage-Islet Organoids to Model Immune-Mediated Pancreatic β cell Pyroptosis upon Viral Infection”的研究论文。此研究构建了人多能干细胞来源的血管化的巨噬细胞-胰岛类器官模型,用于模拟病毒感染情况下巨噬细胞与胰岛β细胞的相互作用,揭示了新冠患者的胰岛中促炎型巨噬细胞可以诱导胰岛β细胞的焦亡。
为探讨免疫细胞是否参与胰腺胰岛β细胞的损伤,团队收集了对照组和新冠患者组的胰腺组织样品并进行了空间转录组和蛋白组学分析。结果显示,与对照组相比,新冠患者组胰岛中表达胰岛素(INS)的β细胞比例显著降低,并且胰岛内有促炎型巨噬细胞的活化和富集。之后,分离了人的胰岛并进行了新冠病毒(SARS-CoV-2)和柯萨奇病毒B4(CVB4)的感染以及单细胞转录组分析,发现两种病毒感染均可导致胰岛内促炎型巨噬细胞的活化和β细胞的焦亡。
为明确新冠患者的胰岛及病毒感染的胰岛内β细胞的焦亡是由病毒直接感染引起的还是促炎型巨噬细胞活化诱导的,团队构建了人多能干细胞来源的血管化巨噬细胞-胰岛类器官模型。首先将胚胎干细胞系(hESCs)经过多种化合物及蛋白因子分别诱导分化为胰腺内分泌细胞(包含β细胞、α细胞和δ细胞等),巨噬细胞和内皮细胞,之后将分化得到的细胞在优化的类器官培养条件下组装成类器官(Vascularized Macrophage-Islet organoids, VMI organoids)。进一步对该类器官模型中的关键细胞成分进行了细胞类型分析和功能评价,发现巨噬细胞和内皮细胞的存在对β细胞响应高浓度葡萄糖和KCl的功能有促进作用。同时,内皮细胞和巨噬细胞在该类器官模型中也保留了其特有的功能。通过进一步在体外诱导并构建包含促炎型巨噬细胞的VMI organoids,团队证实了促炎型巨噬细胞确实能引起胰岛β细胞的焦亡。
在分子机制方面,研究团队通过对巨噬细胞和胰岛β细胞之间的细胞通讯(cell chat)进行分析和验证,发现促炎型巨噬细胞通过TNFSF12-TNFRSF12A这一信号通路诱导胰岛β细胞的焦亡。使用TNFSF12的中和抗体可缓解病毒(SARS-CoV-2或CVB4)诱导的胰岛内β细胞的焦亡和促炎型巨噬细胞诱导的VMI organoids中β细胞的焦亡。此外,研究人员还在新冠患者的胰腺组织样本中确认了胰岛β细胞的焦亡。
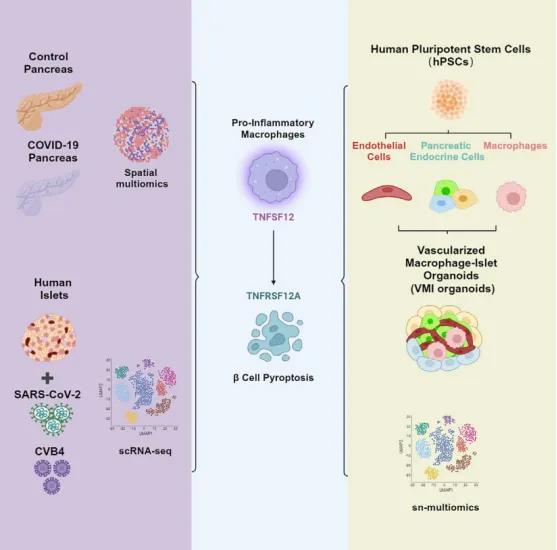
该研究成功构建了基于人多能干细胞(hPSCs)的血管化巨噬细胞-胰岛类器官,为深入探索免疫细胞介导的宿主组织细胞损伤提供了有价值的工具。同时,该研究也揭示了在病毒暴露期间,胰岛β细胞的潜在的损伤机制,为未来的病毒感染介导的糖尿病研究奠定了基础。
康奈尔大学威尔医学院陈水冰教授、Robert E. Schwartz教授和中国医学科学院血液病医院(中国医学科学院血液学研究所)杨柳柳研究员为共同通讯作者。中国医学科学院血液病医院(中国医学科学院血液学研究所)杨柳柳、中国科学院动物所韩玉岭和康奈尔大学威尔医学院张拓为共同第一作者。
参考文献:
1.Heaney, A.I., G.D. Griffin, and E.L. Simon, Newly diagnosed diabetes and diabetic ketoacidosis precipitated by COVID-19 infection. Am J Emerg Med, 2020. 38(11): p. 2491 e3-2491 e4.
2.Rahmati, M., et al., The global impact of COVID-19 pandemic on the incidence of pediatric new-onset type 1 diabetes and ketoacidosis: A systematic review and meta-analysis. J Med Virol, 2022. 94(11): p. 5112-5127.
3.Vehik, K., et al., Prospective virome analyses in young children at increased genetic risk for type 1 diabetes. Nat Med, 2019. 25(12): p. 1865-1872.
4.Krogvold, L., et al., Detection of a low-grade enteroviral infection in the islets of langerhans of living patients newly diagnosed with type 1 diabetes. Diabetes, 2015. 64(5): p. 1682-7.
5.Honeyman, M.C., et al., Association between rotavirus infection and pancreatic islet autoimmunity in children at risk of developing type 1 diabetes. Diabetes, 2000. 49(8): p. 1319-24.
6.Hyoty, H., et al., Mumps infections in the etiology of type 1 (insulin-dependent) diabetes. Diabetes Res, 1988. 9(3): p. 111-6.
7.Wang, X., et al., Associations between human cytomegalovirus infection and type 2 diabetes mellitus: a systematic review and meta-analysis. BMJ Open, 2023. 13(8): p. e071934.
8.Yang, L., et al., A Human Pluripotent Stem Cell-based Platform to Study SARS-CoV-2 Tropism and Model Virus Infection in Human Cells and Organoids. Cell Stem Cell, 2020. 27(1): p. 125-136 e7.