造血干细胞(HSC)是造血再生的“种子”细胞,能在移植后通过自我更新和多向分化来重建造血系统,从而治愈多种血液系统疾病。关于人类脐带血移植和动员外周血移植的回顾性分析显示,即使CD34+细胞数量远低于当前临床指南所规定的数量阈值,供者干细胞也往往能在移植后成功重建造血系统[1,2]。研究团队认为人类数据提示:HSC贵在“精”(质量)而不在“多”(数量)。然而,目前仍不清楚如何在单细胞水平上从功能、免疫表型和转录组特征(“FIT”)三个维度综合评价单个HSC的质量[3,4]。
2025年4月21日,中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛教授、董芳研究员、陈俊仁教授和朱平研究员合作在《Blood》在线发布了题为“Heterogeneity of high-potency multilineage hematopoietic stem cells and identification of ‘Super’ transplantability”的研究论文。该研究运用大规模小鼠HSC单细胞移植及连续移植实验,首次发现具有可持续跨代自我更新并维持多谱系分化潜能的“超级”HSC(Super-class HSC),并揭示“超级”HSC的分子特征。

该研究首先解析了单个HSC移植后HSC池重建的动力学和变化规律:单个HSC在移植后1个月内增殖最显著,4个月时基本达到稳态;HSC数量的增加也同时伴随转录特征的改变,且不同HSC克隆在移植后的重建水平和谱系偏向方面均呈现较大的异质性。
于是,研究团队追踪288个小鼠单个HSC移植后1–4个月造血重建轨迹,发现单个HSC移植后呈现3种不同重建模式,即高水平重建和均衡谱系分化的P1型、相对低水平重建但均衡谱系分化的P2型和低水平重建和偏系分化的P3型。通过对26个HSC克隆连续移植的持续多代功能性追踪,利用团队自主开发的贝叶斯动力学数学模型“stBayes”对多代造血重建模式做系统性的分类,鉴定出“超级型”(Super-class)、“闪电型”(Flash-class)和“细流型”(Trickle-class)三类不同的HSC克隆。其中,“超级型”克隆在连续多代移植后仍可维持高水平的自我更新和多谱系重建能力。研究团队估计超级型克隆在HSC中约占4%的比例。
接下来,研究团队通过单细胞转录组分析发现,超级型克隆所衍生的HSC不但高表达经典HSC基因,同时也高表达团队首次鉴定发现的“超级”特征基因群(Super DEG),并低表达“非超级”特征基因群(Non-Super DEG)。有趣的是,CD27表面标记基因是“非超级”特征基因群的成员之一。
最后,研究团队通过CD27的表达水平来筛选HSC。结果显示,CD27阴性HSC在连续多代移植后仍可以维持高水平的自我更新和多谱系重建能力。通过对稳态下不同CD27表达水平的HSC进行ATAC-seq分析,团队还发现CD27表达阴性HSC的开放染色质区域富集了与干性相关的转录因子。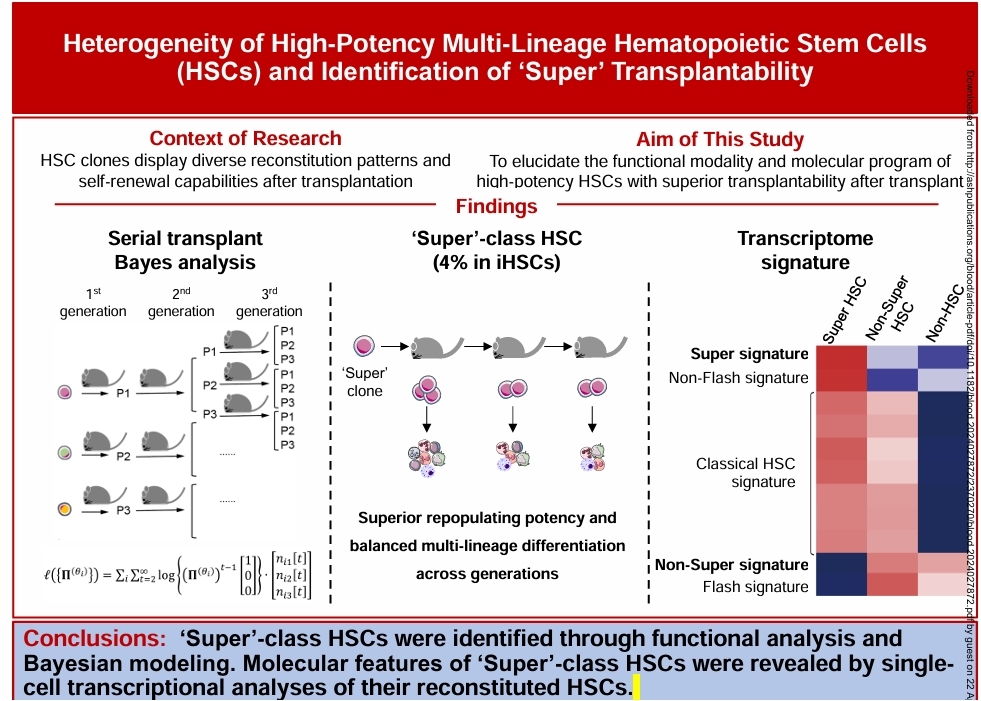
综上所述,研究团队结合单细胞水平多组学实验和贝叶斯动力学数学模型,首次运用多维度视角综合鉴定出“超级”HSC克隆并揭示其分子特征。该研究为如何从移植物中富集高潜能HSC提供新思路,对于未来开发提高移植效能的策略具有重要意义。
中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛教授、董芳研究员、陈俊仁教授和朱平研究员为共同通讯作者,董芳研究员、博士生张森、朱才英(现为海南省医学科学院青年PI)、杨子宁和王丽莎为共同第一作者。该研究获得中国医学科学院血液病医院(中国医学科学院血液学研究所)郝莎研究员、Hideo Ema教授、程辉研究员、张孝兵研究员、兰雨研究员、Toshio Suda教授和中国人民解放军总医院第五医学中心刘兵教授的支持,并获得国家重点研发计划、国家自然科学基金项目、中国医学科学院医学与健康科技创新工程和细胞生态海河实验室创新基金等的支持。
参考文献:
1. Chen J, Gale RP, Feng Y, Hu Y, Qi S, Liu X, Zhu H, Gong X, Zhang W, Liu H et al: Are haematopoietic stem cell transplants stem cell transplants, is there a threshold dose of CD34-positive cells and how many are needed for rapid posttransplant granulocyte recovery? Leukemia 2023.
2. Feng Y, Qi S, Hu Y, Yan W, Ji Y, Wang M, Gong X, Shen Q, Zhang W, Liu H et al: New criteria for estimating numbers of CD34-positive cells in a graft needed for posttransplant bone marrow recovery. Leukemia 2024.
3. Dong F, Cheng H, Ema H, Cheng T: Probing the fate of transplanted hematopoietic stem cells: is the combinational approach “FIT” for purpose? Science China Life Sciences 2020, 63(11):1755-1758.
4. Dong F, Hao S, Zhang S, Zhu C, Cheng H, Yang Z, Hamey FK, Wang X, Gao A, Wang F et al: Differentiation of transplanted haematopoietic stem cells tracked by single-cell transcriptomic analysis. Nature cell biology 2020, 22(6):630-639.