近年来,我国急性心肌梗死的发病率呈明显上升趋势。其病理核心是急性缺血缺氧引发的心肌细胞死亡与修复失衡。尽管现有治疗手段可快速恢复血流,但过度的炎症反应常导致心肌纤维化、心室重构及慢性心力衰竭。由于对损伤心脏免疫细胞募集的源头及调控机制缺乏深入认知,目前缺乏针对这一过程的治疗方案。脾脏作为人体最大的外周免疫器官,同时承担着应急造血的重要功能,在感染、创伤等应激状态下,可通过髓外造血(EMH)活化造血干/祖细胞(HSPCs)产生大量髓系细胞(如单核细胞、巨噬细胞),迁移至损伤心脏参与修复,但在心梗(MI)后,脾脏EMH是否被激活以及如何参与调控心梗后心脏修复尚不清楚。
2025年4月28日,天津医科大学艾玎教授团队和中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛教授团队及程辉研究员团队合作在《Circulation》(IF=35.5)发表了题为“Suppression of prostaglandin I2–type I interferon axis induces extramedullary hematopoiesis to promote cardiac repair after myocardial infarction”的研究论文,揭示了PGI2-IFN轴通过影响脾脏髓外造血调控心肌梗死后心脏修复的具体作用和分子机制,为临床治疗缺血性心脏损伤提供新的思路和靶点。

研究团队首先通过磁共振成像发现,小鼠脾脏体积在MI后的第1天短暂缩小,随后从第3天开始逐渐增大,这一动态变化与心脏巨噬细胞募集的高峰期高度吻合。进一步通过集落形成实验及流式细胞术分析证实,MI后脾脏中HSPCs的数量显著增加,提示脾脏髓外造血增强以响应MI。
为明确脾脏EMH对心梗后心脏修复的直接作用,研究人员使用三种脾脏EMH受损的小鼠模型——Tcf21CreERScf flox/flox转基因小鼠、脾内注射Scf中和型抗体的小鼠和Scf缺陷小鼠脾移植,并对其进行MI手术。结果发现,阻断脾脏EMH引起心梗小鼠心功能显著下降,心脏纤维化加重、血管新生能力明显减弱,心脏组织中促炎基因表达上调,而抗炎基因及促血管生成基因表达下调。进一步研究提示脾脏EMH的激活通过增加血液中Ly6Clow单核细胞及心脏局部修复型巨噬细胞的数量,改善心梗后心脏功能。
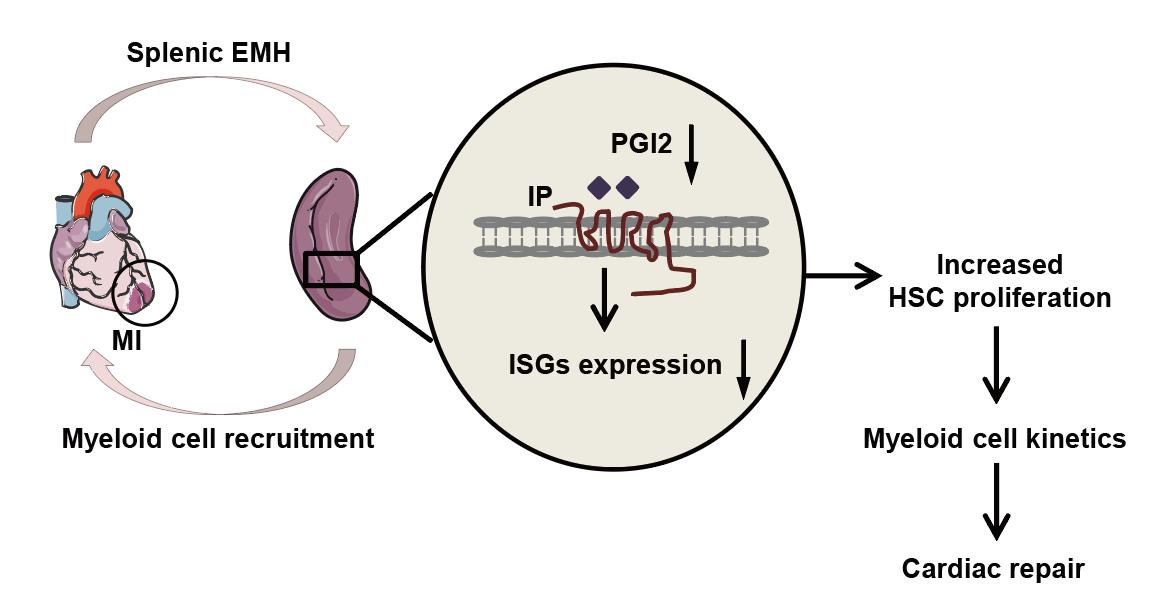
为解析心梗后脾脏EMH增强的具体分子机制,研究整合单细胞测序与脂质代谢组学技术,首先对心梗后1天和3天的小鼠脾脏HSPCs进行单细胞转录组分析,鉴定出12个转录上不同的细胞群。进一步聚焦造血干细胞(HSC)/多能祖细胞(MPP)亚群,发现Ⅰ型干扰素(IFN)通路核心基因(Stat1、Irf7、Ifitm3)在MI后1天和3天持续下调。通过计算HSC亚群的IFN刺激基因(ISG)响应指数,发现HSC亚群的细胞干性与ISG得分呈正相关,提示MI通过抑制Ⅰ型IFN信号解除HSC静止状态,驱动其向髓系祖细胞分化。然而脾脏中IFNα和IFNβ的含量并无改变,这表明可能存在其它非经典刺激因子引起IFN信号通路的改变。花生四烯酸代谢物在HSPC增殖分化中有重要意义,通过代谢组学等技术,结果揭示PGI2通过HSCs中cAMP/PKA-SP1通路激活Ⅰ型IFN信号。
基于上述机制,研究进一步探索靶向PGI2/IP通路对MI后心脏修复的治疗潜力。结果显示,IP缺陷小鼠在MI后心功能明显改善,梗死区血管密度增加,且心肌纤维化程度减轻。分子层面,IP缺失通过增强脾脏EMH,使心脏中M2型巨噬细胞浸润增加,同时抑制M1型巨噬细胞的表达。该研究首次揭示,MI通过“PGI2-IFN”轴,精准调控脾脏EMH的活化方向,而干预这一通路可定向优化心脏免疫微环境,为缺血性心脏病的治疗提供了全新靶点。该研究不仅填补了MI后免疫细胞来源及脾脏EMH调控机制的空白,更创新性地将花生四烯酸代谢组学与造血干细胞生物学相结合,为干预心血管疾病提供了新思路。
天津医科大学艾玎教授、中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛教授和程辉研究员为共同通讯作者。天津医科大学吕慧珍博士(现任北京大学第一医院副研究员)、中国医学科学院血液病医院(中国医学科学院血液学研究所)王晨晨博士、天津医科大学博士生刘泽宁为共同第一作者。该工作与中国医学科学院血液病研究所(中国医学科学院血液学研究所)朱平研究员和天津医科大学余鹰教授团队合作完成,并得到国家自然科学基金、国家重点研发计划、中国医学科学院医学与健康科技创新工程和细胞生态海河实验室创新基金等的支持。
参考文献:
1. Lv H, Wang C, Liu Z, Quan M, Li K, Gou F, Shi X, Liu Q, Yu Y, Zhu P, Cheng H, Cheng T, Ai D. Suppression of the Prostaglandin I2-Type 1 Interferon Axis Induces Extramedullary Hematopoiesis to Promote Cardiac Repair After Myocardial Infarction. Circulation. 2025 Apr 28.