造血分化过程受其内在调节因子和外在造血微环境(niche)的精细调控,转录因子ATF4被报道在胚胎和成体造血干细胞(HSC)的功能维持中起着至关重要的作用。胚胎造血过程中,Atf4基因的纯合缺失会导致小鼠胚胎严重贫血[1]和胎肝HSC扩增障碍[2],进而引发胎鼠围产期死亡。而在成体小鼠中,Atf4基因全部敲除的小鼠仅表现轻微贫血;在Scl-Cre-ERT;Atf4-/-小鼠中,呈现HSC无效扩增、植入不良和髓系造血偏倚等衰老表型[3]。目前报道中,ATF4对于造血细胞的调控,可以通过其介导的内源和外源机制共同实现:一方面ATF4通过HRI-elF2aP-ATF4轴[4]、HIF1α和p16Ink4a调控造血[3];另一方面ATF4通过上调胎肝微环境中Angptl3的分泌来维持HSC扩增[2]。然而,ATF4在骨髓微环境中的确切功能及ATF4如何调节成体造血尚缺乏全面系统的研究。
近日,中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛/程辉/朱平团队与浙江大学钱鹏旭团队合作在《Blood》(IF=20.3)在线发布了题为“The ATF4-RPS19BP1 axis modulates ribosome biogenesis to promote erythropoiesis”的研究论文。该研究构建了多种条件性基因敲除小鼠模型,阐述了在成体造血中Atf4基因缺失引起HSC功能缺陷和红系分化阻滞;利用单细胞转录组测序等多种组学及分子生物学技术,进一步证明ATF4能够直接激活Rps19bp1基因的转录,从而调节40S核糖体亚基的组装,协调核糖体生物发生进而调控红系造血。

首先,研究人员利用四种细胞类型特异性基因敲除小鼠模型,在Cdh5+内皮细胞、Prx1+骨髓基质细胞、Osx+骨祖细胞和Mx1+造血细胞中条件性敲除Atf4基因,揭示了ATF4在微环境和造血中的作用。结果表明,在Prx1+骨髓基质细胞敲除Atf4基因会显著减少基质细胞比例和数量,降低其体外基质成纤维样祖细胞(CFU-F)形成能力,抑制其向成骨分化。然而在niche细胞中敲除Atf4基因并不影响造血;相反,Atf4基因缺失的造血细胞表现出显著的HSC自我更新能力缺陷,祖细胞功能降低和红系分化受抑。
在红系发育过程中,红系前体细胞需要大量合成血红蛋白,细胞周期更短,承担着更高的核糖体合成、蛋白翻译和线粒体氧化应激压力等。单细胞RNA-seq数据表明缺失Atf4基因后更多红系祖细胞进入细胞周期,承受更高的复制压力,从而导致DNA损伤和细胞凋亡。结合单细胞RNA-seq、bulk RNA-Seq、ATAC-Seq、H3K4me3 CUT&Tag等测序,选出ATF4的潜在靶基因Rps19bp1。结果表明,缺失Atf4基因导致细胞中40S核糖体蛋白丰度降低,蛋白翻译速率降低。而Rps19bp1回补实验则挽救了这一现象,同样挽救了Atf4基因缺失导致的红系分化抑制。最后,该研究证明在5-FU诱导的应激条件下,Atf4基因的缺失阻碍了造血谱系的再生,后者依赖高效的核糖体生物合成。
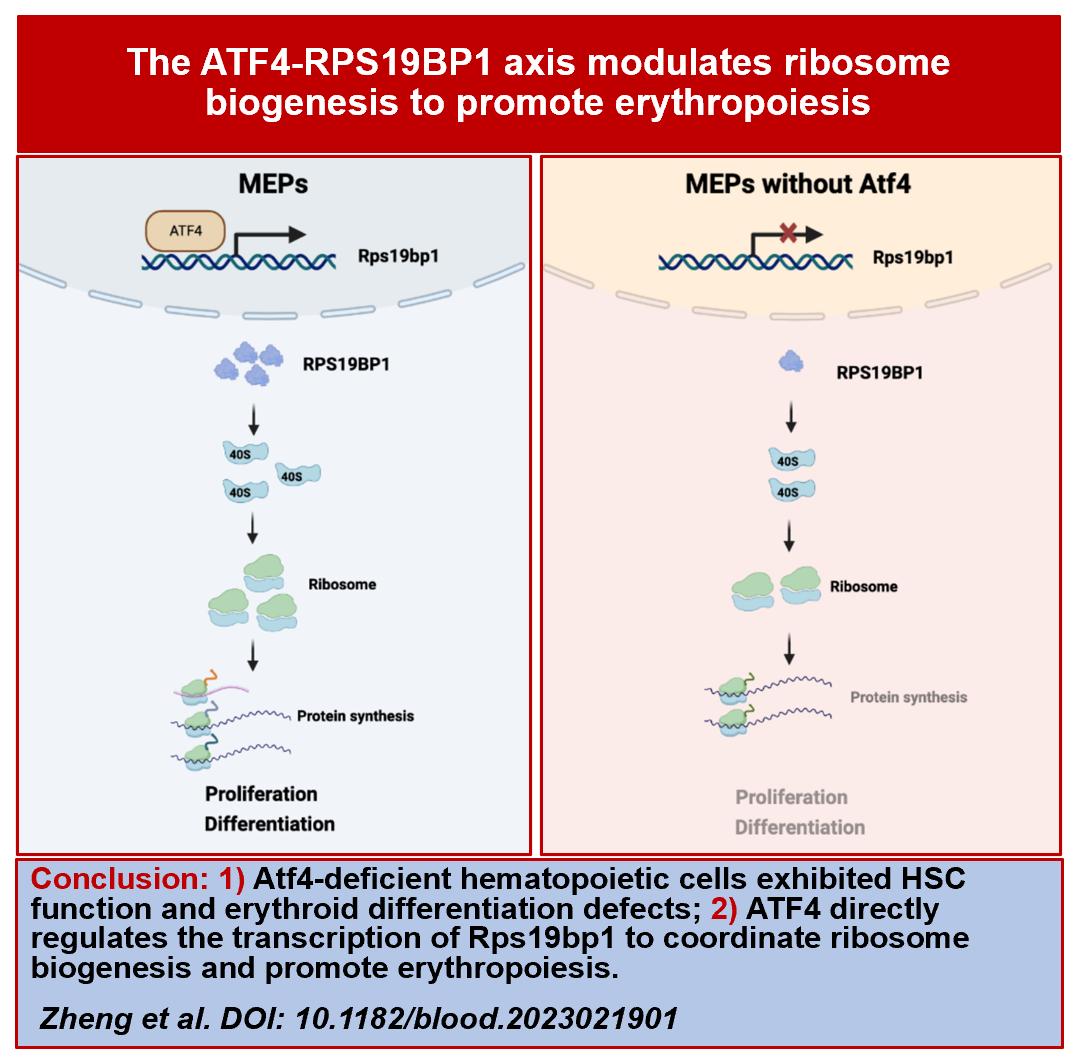
综上所述,通过使用微环境和造血细胞特异性条件基因敲除小鼠模型,研究人员发现,与胎肝造血不同,ATF4以内源调控的方式调节小鼠成体骨髓HSC功能和红细胞生成,阐明了ATF4-RPS19BP1调控红系造血的新机制,将红系分化及核糖体生物合成和蛋白质翻译联系起来。这一发现对理解和治疗核糖体相关的红系造血异常疾病如先天性纯红细胞再生障碍性贫血等具有广泛的指导意义。
中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛教授、程辉研究员、朱平研究员和浙江大学钱鹏旭研究员为共同通讯作者。中国医学科学院血液病医院(中国医学科学院血液学研究所)郑昭烽博士、杨尚达副研究员、天津医科大学博士生苟芳琳、中国医学科学院血液病医院(中国医学科学院血液学研究所)博士生唐晁、浙江大学张召茹博士后为共同第一作者。该项目获得国家重点研发计划、国家自然科学基金、中国医学科学院医学与健康科技创新工程和细胞生态海河实验室基金等的支持。
参考文献:
1. Masuoka HC, Townes TM. Targeted disruption of the activating transcription factor 4 gene results in severe fetal anemia in mice. Blood. 2002;99(3):736-745.
2. Zhao Y, Zhou J, Liu D, et al. ATF4 plays a pivotal role in the development of functional hematopoietic stem cells in mouse fetal liver. Blood. 2015;126(21):2383-2391.
3. Sun Y, Lin X, Liu B, et al. Loss of ATF4 leads to functional aging-like attrition of adult hematopoietic stem cells. Sci Adv. 2021;7(52):eabj6877.
4. Suragani RN, Zachariah RS, Velazquez JG, et al. Heme-regulated eIF2α kinase activated Atf4 signaling pathway in oxidative stress and erythropoiesis. Blood. 2012;119(22):5276-5284.